Questões Militares
Para técnico - química
Foram encontradas 300 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considere a seguinte reação reversível de dissociação de um ácido fraco.
HA <-> H+ + A-
Sabendo-se que o grau de ionização desta reação é 0,5 e que
antes do início da dissociação a concentração de ácido era de 1mol/l. Assinale a opção que apresenta o valor da constante
de equilíbrio.
Assinale a opção que completa corretamente as lacunas da sentença abaixo.
Considere que determinado ácido sofre uma diluição, de modo que sua concentração de íons H+ é alterada de 4x10-7mol/l para 5x10-8 mol/l. Sendo assim, é correto afirmar que o pH da solução original foi alterado de____________ para ___________ .
Dados:
log(2) = 0,301
log(3) = 0,477
log(5) = 0,698
Considere a reação reversível à seguir.
A + B <-> C + D
Sabendo-se que a notação [x] indica a concentração de um
determinado componente x, assinale a opção que apresenta o
valor da constante de equilíbrio da reação.
Observe o composto a seguir.
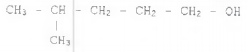
Assinale a opção que apresenta o nome do composto acima.
Sabe-se que a corrosão pode ocorrer sob diferentes formas, e o conhecimento das mesmas é muito importante no estudo dos processos corrosivos.
Correlacione as formas de corrosão às suas respectivas características, e assinale a opção que apresenta a sequência correta.
FORMAS DE CORROSÃO
I - Filiforme
II - Intergranular
III- Esfoliação
IV - Pites
V - Uniforme ou generalizada
CARACTERÍSTICAS
( ) Se processa em diferentes camadas e o produto de corrosão formado entre as estruturas de grãos alongados separa as camadas ocasionando o inchamento do material metálico.
( ) Se processa sob a forma de finos filamentos que se propagam em diferentes direções, ocorrendo geralmente em superfícies metálicas revestidas com tintas ou com metais, provocando o deslocamento do revestimento.
( ) Se processa em pontos ou pequenas áreas localizadas na superfície metálica produzindo cavidades.
( ) Se processa por toda a extensão da superfície metálica ocorrendo perda uniforme de espessura.
( ) Se processa entre os grãos da
rede cristalina do material
metálico, o qual perde suas
propriedades mecânicas e pode
fraturar quando solicitado
por esforços mecânicos.
Com relação ao equilíbrio das reações químicas, analise as afirmativas abaixo.
I - A expressão matemática da constante de equilíbrio (K) relaciona as concentrações de reagentes e produtos no equilíbrio.
II - Os efeitos da perturbação de um equilíbrio químico são previstos pelo Princípio de Le Chatelier.
III- Quando o valor da constante de equilíbrio for grande (K muito maior que 1), a reação é favorável aos reagentes e as concentrações dos produtos no equilíbrio são menores que as dos reagentes.
Assinale a opção correta.
Observe as reações químicas a seguir.
H2O(I) → H2(g) + 1/2O2(g) Δh = +283 kJ
H2(g) + 1/2O2(g) → H2O(g) Δh = -242 kJ
Qual é o valor do calor de vaporização da água?
A curva de calibração obtida para a determinação de enxofre através do espectro de emissão em chamas, obedece o seguinte comportamento linear:
S = 0,99CS + 0, 33
Onde Cs representa a concentração de enxofre em partes por
milhão e S é uma medida da intensidade relativa da linha de
emissão do enxofre. Tal curva foi obtida mediante realização
de 10 repetições. De acordo com estas informações, é correto
afirmar que o valor da sensibilidade da calibração é dada
por:
Observe a reação de oxirredução não balanceada a seguir.
Cu(s) + Ag+(aq) → Ag(s) + Cu2+(aq)
A soma de todos os coeficientes estequiométricos da reação
balanceada é :
O esquema abaixo, ilustra uma pilha eletroquímica conhecida como Pilha da Daniell.
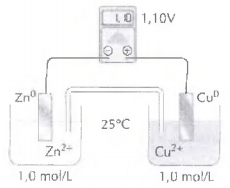
Assinale a opção correta com relação ao processo eletroquímico que ocorre na pilha de Daniell.
Observe a reação a seguir.
a Al2O3 + b HCl → c AlCl3 + d H2O
Assinale a opção que corresponde aos coeficientes corretamente balanceados.
O cloro é um gás amarelo-esverdeado e foi preparado, pela primeira vez, pelo químico sueco Karl Wilhelm Scheele em 1774. A reação abaixo ocorre quando o gás cloro (Cl2) é dissolvido em uma solução aquosa básica:
Cl2(g) + 2OH- (aq) → OCl- (aq) + Cl- (aq) + H2O(I)
Assinale a opção que apresenta a nomenclatura correta dos íons OCl- e Cl- , respectivamente.