Questões Militares
Para professor - química
Foram encontradas 99 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A tabela a seguir apresenta algumas informações a respeito de alguns ácidos graxos.
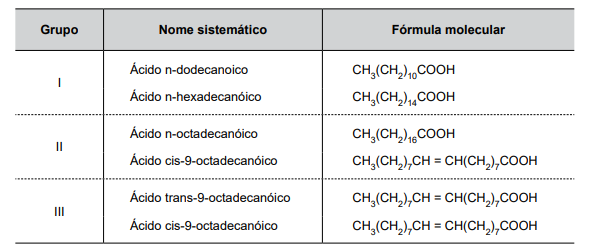
Dentro de cada grupo, I, II e III, os ácidos graxos que apresentam os pontos de fusão mais altos são, correta e respectivamente:
Na figura, é apresentada a fórmula de Haworth para a forma hemiacetálica cíclica de um monossacarídeo.
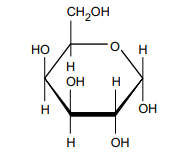
Trata-se de uma __________ e a conformação do átomo de carbono anomérico é _________ . Em relação à sua estrutura de cadeia aberta, a ciclização ocorreu entre os átomos de carbono de números _____________ .
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
Uma mistura de fenilamina, a anilina, C6 H7N, e fenilmetanol, o álcool benzílico, C7H8O, foi submetida a um procedimento para separação, conforme representado no esquema da figura a seguir.
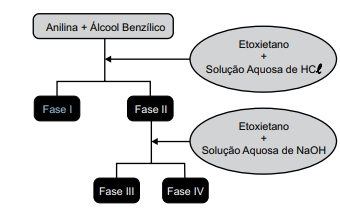
O álcool benzílico e um sal de amina estão presentes,
preponderante e respectivamente, nas fases
O composto orgânico oxigenado, X, reage, em condições adequadas, de acordo com as equações de reação representadas a seguir.
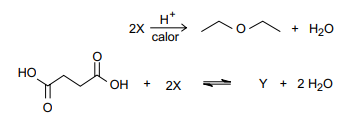
O composto Y tem a seguinte fórmula molecular:
Foi adicionada a uma bomba calorimétrica selada, com volume invariável a 25 ºC, uma mistura gasosa de um hidrocarboneto saturado e oxigênio, com pressão total P1 , em proporção estequiométrica para reação de combustão completa.
Após acionada a ignição, a mistura gasosa reagiu completamente. Considerando que o volume do líquido formado na reação é desprezível em relação ao volume total do compartimento e que a pressão P2 no interior da bomba calorimétrica após a reação 25 ºC é igual a 0,5 x P1 , a fórmula molecular do hidrocarboneto empregado no experimento é:
Foram misturados sob agitação Ag2S sólido e uma solução de saturada de H2S (0,1 mol/L) em H+ (0,15 mol/L).
Considerem-se as constantes de equilíbrio a 25 ºC:
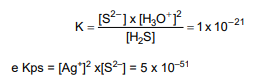
Nessa temperatura, ao se atingir o equilíbrio, a concentração de íons Ag+ na solução será:
Um procedimento para obtenção de estanho metálico foi realizado a partir do óxido de estanho (IV), em um compartimento selado que, após ser evacuado, foi preenchido com gás hidrogênio. Ao ser atingido o equilíbrio químico a 900 K, a atmosfera gasosa no interior do compartimento era composta por 45% gás hidrogênio, em volume.
A constante de equilíbrio, Kp, para essa reação a 900 K é igual a, aproximadamente,
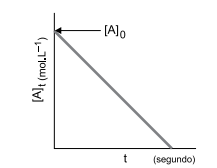
Os dados do estudo cinético de uma reação representada por
2 A → 2B + 3C
possibilitaram construção de uma curva de rapidez da reação, representada na figura a seguir.
(P. Atkins; L. Jones; Princípios de Química: questionando a vida
moderna e o meio ambiente. 5a
ed. Trad. Ricardo Bicca de Alencastro.
Porto Alegre: Bookman, 2012. Adaptado)
A ordem dessa reação e as unidades de sua constante
de velocidade são:
Considere as seguintes representações de equações de reação:
I. A (g) + B (g) → AB (s) ΔHo > 0
II. C (l) + D (s) → CD (g) ΔHo > 0
A respeito da espontaneidade dessas reações, é correto afirmar que
A reação da amônia com oxigênio pode ocorrer sob condições adequadas, de acordo com a equação a seguir.
Equação 1
2 NH3(g) + 3/2 O2(g) → N2(g) + 3 H2O(g)
Considere as seguintes equações termoquímicas envolvendo a amônia:
2 NH3(g) + 7/2 O2(g) → 2 NO2(g) + 3 H2O(g) ΔHo = –566 kJ
3 NO2(g) + 4 NH3(g) → 7/2 N2(g) + 6 H2O(g) ΔHo = –1370 kJ
A entalpia da reação da combustão de um mol de amônia representada na equação 1 é igual a, aproximadamente
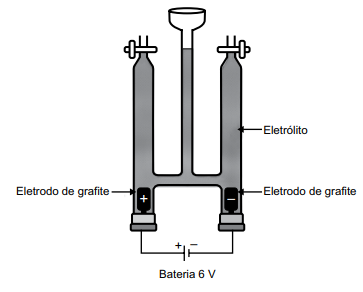
Em uma aula prática de química, foi montada a aparelhagem representada na figura a seguir, para um experimento de eletrólise, usando-se como eletrólito, uma solução aquosa de iodeto de sódio 1,0 mol/L em pH = 7 e algumas gotas de uma solução aquosa de amido.
Dados: potencial padrão de redução a 25 ºC.
O2(g) + H2O(l) + 4e–
→ 4OH–(aq) Eo
= +0,40 V
I2(s) + 2 e– → 2 I– (aq) Eo = +0,54 V
O2(g) + 4 H+(aq) + 4e– → 2 H2O(l) Eo = +1,23 V
2 H2O (l) + 2e– → H2(g) + 2OH– (aq) Eo = –0,83 V
Na+(aq) + 1e– → Na(s) Eo = –2,71 V
(P. Atkins, P.; L. Jones; Princípios de Química: questionando a vida
moderna e o meio ambiente. 5ª ed. Porto Alegre: Bookman, 2012)
Ao iniciar o experimento, verificou-se o sugimento de
coloração azulada em um dos compartimentos eletródicos e a formação de um gás no outro compartimento.
Esse fato ocorreu devido à formação de iodo no
A bateria de Thomas Edison desenvolvida no século 19 é um dispositivo eletroquímico que funciona de acordo com o esquema simplificado representado na figura. No sentido da descarga, o potencial fornecido por par de eletrodos é igual a +1,35V
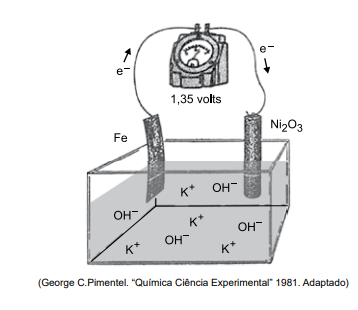
Considere as informações:
Semirreação Potencial padrão de redução (Eº)
I. Fe(OH)2 (s) + 2e– → Fe(s) + 2OH– (aq) X
II. Ni2O3(s) + 3H2O (l) + 2e– → 2Ni(OH)2(s) + 2OH–
(aq) +0,48V
Na bateria de Thomas Edison em operação no sentido da descarga, o eletrodo em que se processam a oxidação e o
potencial padrão de redução da equação I são:
Uma solução aquosa de cianeto de sódio foi adicionada a uma solução aquosa de permanganato de potássio, em meio básico. Assim, foram formados o óxido de manganês (IV) sólido e o íon cianato, CNO– .
Na semirreação envolvendo um mol do íon cianeto há a participação de ________ elétrons.
No balanceamento da equação global da reação envolvendo 2 mol do íon permanganato, participam _______ de íons hidroxila representados no lado dos _______ da equação de reação.
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
Considere os seguintes pares de compostos:
I. HF e HI
II. NH3 e H2O
III. C2 H2 e C2 H4
Os compostos que apresentam maior acidez (menor valor de pKa) em I, II e III são, correta e respectivamente:
O sulfeto de alumínio é um sólido que pode ser obtido, em condições adequadas, entre a reação do alumínio e do gás sulfeto de hidrogênio de alta pureza. Nessa reação, forma-se gás hidrogênio como subproduto.
Ao serem misturados 3,0 mol de alumínio e 6,0 mol de sulfeto de hidrogênio nas condições adequadas para reação, a quantidade máxima, em mol, de sulfeto de alumínio que poderá ser formada e a massa do reagente em excesso são:
A fosfina, PH3 , é uma substância gasosa em temperatura ambiente que pode ser obtida a partir da reação do fosfeto de cálcio sólido com água. Nessa reação, forma-se também o hidróxido de cálcio.
Uma certa massa de fosfeto de cálcio foi adicionada em água em um béquer aberto totalizando uma mistura reacional com massa igual a 1.000 g. Ao término da reação com consumo total do fosfeto de cálcio, a massa da mistura no interior do béquer era igual a 796 g.
A massa de água da mistura reacional no béquer era igual a
Três líquidos foram aquecidos em recipientes abertos, sob as mesmas condições de taxa de aquecimento e de pressão ambiente. O líquido 1 é água destilada; o líquido 2 é uma solução aquosa de cloreto de potássio 0,1 mol/L; e o líquido 3 é uma solução aquosa de nitrato de alumínio 0,1 mol/L.
Ao atingirem a temperatura de ebulição, comparando-se suas pressões de vapor, tem-se, corretamente, que:
Para um experimento sobre o estudo das propriedades de coloides, foram aquecidos 50 mL de água destilada até a ebulição e adicionadas 30 gotas de solução aquosa de cloreto de ferro (III) 1 mol/L. Após resfriada, essa mistura foi transferida para um saquinho constituído de uma membrana semipermeável, e esse saquinho foi selado nas duas extremidades e colocado no interior de um béquer contendo água destilada na temperatura ambiente, conforme representado na figura a seguir.
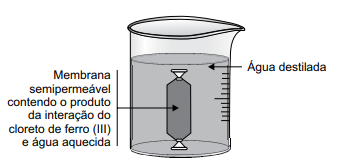
Após 30 minutos, foram coletadas três amostras do líquido do béquer, de 2 mL cada, e colocadas em três tubos de ensaio, com os quais foram realizados os seguintes testes.
Tubo 1 – caráter acido-base: adição de 5 gotas de solução de indicador azul de bromotimol.
Tubo 2 – presença de íons cloreto: adição de 2 gotas de solução de ácido nítrico 0,1 mol/L e 5 gotas de solução de nitrato de prata, 0,1 mol/L.
Tubo 3 – presença de íons ferro (III): adição de 20 gotas de solução de tiocianato de amônio 0,5 mol/L.
Dados de coloração do indicador azul de bromotimol:
pH < 6.4 cor amarela;
6,4 < pH < 7,6 cor verde;
pH > 7,6 cor azul.
Os testes dos tubos I, II e III apresentaram, correta e respectivamente, os resultados:
Uma solução saturada de brometo de amônio foi preparada usando-se 49,0 g de H2 O a 50 ºC. Essa solução foi transferida quantitativamente para um balão volumétrico e foi adicionada água destilada, até atingir a capacidade volumétrica do balão, que era de 250 mL. O gráfico a seguir apresenta a curva de solubilidade do brometo de amônio.
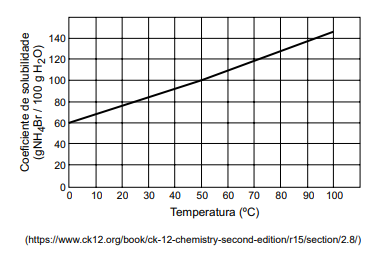
A concentração molar dessa solução é igual a, aproximadamente,
Dois cilindros mantidos sob a mesma temperatura contêm gases puros, sendo ozônio no cilindro 1 e dióxido de enxofre no cilindro 2. A capacidade volumétrica do cilindro 2 é igual à metade da capacidade volumétrica do cilindro 1. Os dois gases estão sob a mesma pressão.
A relação entre a massa de gás do cilindro 1 e a massa de gás do cilindro 2 é igual a: