Questões Militares
Para cadete do exército
Foram encontradas 1.507 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Um cubo de massa 4 kg está inicialmente em repouso sobre um plano horizontal sem atrito. Durante 3 s, aplica-se sobre o cubo uma força constante 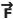 , horizontal e perpendicular no centro de
uma de suas faces, fazendo com que ele sofra um deslocamento retilíneo de 9 m, nesse intervalo
de tempo, conforme representado no desenho abaixo.
, horizontal e perpendicular no centro de
uma de suas faces, fazendo com que ele sofra um deslocamento retilíneo de 9 m, nesse intervalo
de tempo, conforme representado no desenho abaixo.
No final do intervalo de tempo de 3 s, os módulos do impulso da força  e da quantidade de
movimento do cubo são respectivamente:
e da quantidade de
movimento do cubo são respectivamente:
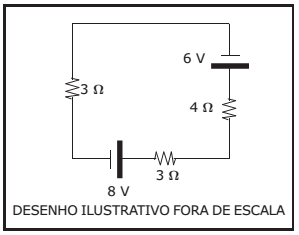
O desenho abaixo representa um circuito elétrico composto por resistores ôhmicos, um gerador ideal e um receptor ideal.
A potência elétrica dissipada no resistor de 4 Ω do circuito é:
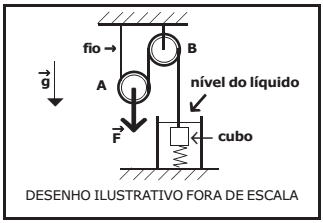
Um cubo homogêneo de densidade ρ e volume V encontra-se totalmente imerso em um líquido homogêneo de densidade ρo contido em um recipiente que está fixo a uma superfície horizontal.
Uma mola ideal, de volume desprezível e constante elástica k, tem uma de suas extremidades presa ao centro geométrico da superfície inferior do cubo, e a outra extremidade presa ao fundo do recipiente de modo que ela fique posicionada verticalmente.
Um fio ideal vertical está preso ao centro geométrico da superfície superior do cubo e passa por duas roldanas idênticas e ideais A e B. A roldana A é móvel a roldana B é fixa e estão montadas conforme o desenho abaixo.
Uma força vertical de intensidade F é aplicada ao eixo central da roldana A fazendo com que a distensão na mola seja X e o sistema todo fique em equilíbrio estático, com o cubo totalmente imerso no líquido.
Considerando a intensidade da aceleração da gravidade igual a g, o módulo da força F é:
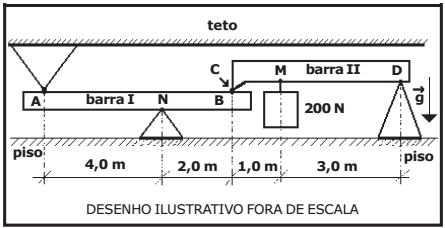
O desenho abaixo representa um sistema composto por duas barras rígidas I e II, homogêneas e de massas desprezíveis na posição horizontal, dentro de uma sala. O sistema está em equilíbrio estático.
No ponto M da barra II, é colocado um peso de 200 N suspenso por um cabo de massa desprezível. A barra I está apoiada no ponto N no vértice de um cone fixo no piso. O ponto A da barra I toca o vértice de um cone fixo no teto. O ponto B da barra I toca o ponto C, na extremidade da barra II. O ponto D, localizado na outra extremidade da barra II, está apoiado no vértice de um cone fixo no piso.
Os módulos das forças de contato sobre a barra I, nos pontos A e N, são respectivamente:
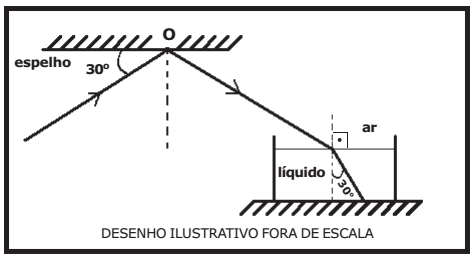
Um raio de luz monocromática propagando-se no ar incide no ponto O, na superfície de um espelho, plano e horizontal, formando um ângulo de 30° com sua superfície.
Após ser refletido no ponto O desse espelho, o raio incide na superfície plana e horizontal de um líquido e sofre refração. O raio refratado forma um ângulo de 30° com a reta normal à superfície do líquido, conforme o desenho abaixo. Sabendo que o índice de refração do ar é 1, o índice de refração do líquido é:
Dados: sen 30°=1/2 e cos 60° =1/2 ; sen 60°= √3/2 e cos 30°= √3/2
Leia o soneto a seguir e marque a alternativa correta quanto à proposição apresentada.
Se amor não é qual é este sentimento?
Mas se é amor, por Deus, que cousa é a tal?
Se boa por que tem ação mortal?
Se má por que é tão doce o seu tormento?
Se eu ardo por querer por que o lamento
Se sem querer o lamentar que val?
Ó viva morte, ó deleitoso mal,
Tanto podes sem meu consentimento.
E se eu consinto sem razão pranteio.
A tão contrário vento em frágil barca,
Eu vou por alto-mar e sem governo.
É tão grave de error, de ciência é parca
Que eu mesmo não sei bem o que eu anseio
E tremo em pleno estio e ardo no inverno.
O artista do Classicismo, para revelar o que está no universo, adota uma visão
Leia poesia a seguir.
Não indagues, Leucónoe
Não indagues, Leucónoe, ímpio é saber,
a duração da vida
que os deuses decidiram conceder-nos,
nem consultes os astros babilônios:
melhor é suportar tudo o que acontecer.
[…]
Enquanto conversamos,
foge o tempo invejoso.
Desfruta o dia de hoje, acreditando
o mínimo possível no amanhã.
A segunda estrofe da poesia horaciana faz referência ao(s)
Assinale a alternativa que contém, na sequência, a forma correta da substituição da voz passiva analítica pela voz passiva pronominal e, ao mesmo tempo, a substituição dos termos destacados pelos pronomes oblíquos correspondentes.
Era notada no olhar dela uma expressão feliz.
Era vista no rosto dele a palidez da morte.
São vistas no corpo dele as marcas das balas.
Foi notado no rosto dele algo de estranho.
Foi inserida na opinião dele um dado novo.
“Ao responder pelo crime de_____________, o acusado, surpreendido em ________________, foi ______________ em uma _____________ que durou pouco mais de duas horas, após as quais deixou _____________ a sua _____________ em todas as folhas do depoimento.”
As lacunas do período acima podem ser completadas, respectivamente, com
Leia o texto a seguir.
Somente uma bala
Vocês têm só uma bala na agulha para capturar a atenção dos leitores: as primeiras linhas de um texto. Se elas não forem capazes de despertar interesse, tchau e bênção. [...]
O erro pode estar na escolha dos assuntos. Ou na qualidade dos textos. Ou nas duas coisas. Os assuntos podem ser atraentes. Se oferecidos por meio de textos medíocres, não serão lidos. Os textos podem ser gramaticalmente corretos e contar uma história com começo, meio e fim. Se não forem instigantes, bye, bye, leitores.
NOBLAT, Ricardo. A arte de fazer um jornal diário. São Paulo, Contexto, 2003, p.86 (fragmento).
De acordo com o fragmento do texto, de Ricardo Noblat, o autor defende a ideia de que o escritor deve