Questões Militares
Para primeiro tenente
Foram encontradas 10.620 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considerando a curva tensão versus deformação obtida pelo ensaio de tração convencional de um material dúctil, com escoamento nítido, observa-se o seguinte:
I. A região de comportamento elástico, regime elástico, é delimitada a partir da origem até a tensão limite de elasticidade do material.
II. No regime plástico, pode-se obter a tensão limite de proporcionalidade do material, o módulo de elasticidade, a tensão limite de elasticidade e a resistência.
III. No regime plástico, pode-se determinar a tensão limite de resistência do material, a tensão limite de ruptura, o alongamento, a estricção e a tenacidade.
IV. A tenacidade entendida como a capacidade do material absorver energia até o seu escoamento é numericamente igual à área delimitada na tensão de escoamento.
Está correto apenas o que se afirma em
O ensaio de dureza Vickers é um método bastante utilizado devido ao fato de permitir a determinação da dureza de uma ampla gama de materiais em diferentes condições, permitindo também a obtenção da dureza de constituintes individuais do material.
Portanto, pode-se dizer que o método de Vickers
A Equação de Nernst, desenvolvida pelo químico e físico alemão Walther Hermann Nernst, é a relação quantitativa que permite calcular a força eletromotriz de uma pilha para concentrações de íons diferentes de uma unidade. Também é usada para cálculos em titulação de oxidação-redução.
A equação a 25°C pode ser escrita de forma reduzida como: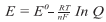
Sendo: R = 8,315 J K-1 mol-1; T = 298,2 K (25°C); F = 96485 C mol-1
Calcule a força eletromotriz para a seguinte pilha a 25°C: Fe / Fe2 + (0,02M) || Cu2
+(0,2M) / Cu
Dados: potencial padrão de redução (Eº Fe = -0,44V e Eº Cu = +0,40V).
Corrosão é a destruição ou deterioração de um material devido à reação química ou eletroquímica com seu meio. A corrosão é a transformação de um material pela sua interação química ou eletroquímica com o meio.
Sobre os exemplos de métodos de combate à corrosão, é incorreto afirmar que
Inibidor de corrosão é uma substância ou mistura de substâncias que, quando presente em concentrações adequadas, no meio corrosivo, reduz ou elimina a corrosão. As seguintes afirmativas referem-se ao inibidor de corrosão.
I. Inibidores protetivos emulsionáveis em água deixam por evaporação uma película oleosa aplicada por diluição em água.
II. O método de proteção usando protetivos temporários é baseado na obtenção de uma película superficial, fácil de aplicar e remover.
III. Inibidores catódicos têm a capacidade de formar películas sobre as áreas anódicas e catódicas, interferindo com a ação eletroquímica.
IV. Inibidores anódicos atuam favorecendo as reações anódicas, protegendo o cátodo da corrosão. São eficazes, mesmos em pequenas concentrações.
Está correto apenas o que se afirma em
A cavitação é um fenômeno indesejado no funcionamento das máquinas de fluxo e ocorre em regiões de altas velocidades e baixa pressão dos tubos de sucção em máquinas motoras e geradoras. Ela pode provocar corrosão, desgaste, remoção de partículas e destruição de partes dos rotores das bombas. Tal circunstância faz com que as condições de sucção tenham papel importante no projeto e nas especificações das instalações para o correto funcionamento, tanto de bombas quanto de turbinas.
Com relação ao funcionamento de máquinas de fluxo e o fenômeno da cavitação, marque a alternativa correta.
Muitos foram os pesquisadores que contribuíram para as leis conhecidas como Leis dos Gases. Algumas das contribuições mais importantes dos gases ideais estão resumidas nos postulados na lei de Boyle, lei de Charles, lei de Gay-Lussac e lei de Clapeyron. Com relação às leis dos gases, analise as afirmativas a seguir.
I. De acordo com a lei de Boyle, a pressão e o volume de um gás são inversamente proporcionais entre si para um gás ideal.
II. De acordo com a lei de Gay-Lussac, a velocidade de difusão e de efusão de um gás é inversamente proporcional à raiz quadrada de sua densidade.
III. De acordo com a lei de Charles, o volume de um gás é diretamente proporcional à sua temperatura absoluta.
IV. De acordo com a lei de Clapeyron, à volume constante, a pressão de uma certa massa constante de um gás é proporcional à temperatura absoluta a qual está submetida.
Está correto apenas o que se afirma em
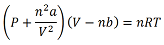
Na equação, as variáveis P, V, n, R, T são usuais, mas os parâmetros (a) e (b) são conhecidos como constantes de Van Der Waals.
Considerar R: 0,0821 atm · L · K−1 · mol−1
Tabela – Constantes de Van Der Waals
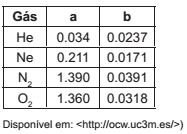
Utilizando a equação de Van Der Waals para gases reais, calcule a pressão real exercida por 16 gramas de gás oxigênio que se encontra em um recipiente de 1L a 27°C.
Para misturas binárias, as condições de equilíbrio para várias composições podem ser facilmente visualizadas em diagramas do tipo Txy e xy, à pressão constante, ou Pxy e xy, à temperatura constante.
Diagrama binário para a mistura Benzeno e Tolueno.
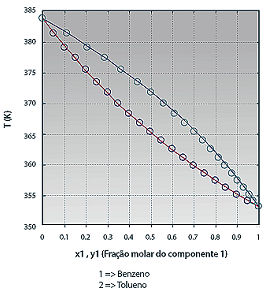
(Disponível em: <http://labvirtual.eq.uc.pt> )
A nitroglicerina é um líquido oleoso de cor amarelo-pálida. É altamente sensível ao choque. O simples ato de balançar o líquido pode causar a explosiva decomposição em gases de nitrogênio, dióxido de carbono, água e oxigênio. A equação química abaixo representa essa reação.
4C3H5N3O9 (l ) → 6N2 (g ) + 12CO2 (g ) + 10H2O (g ) + O2 (g )
Calcule o volume de gases CO2 produzido quando uma amostra de 200 gramas de nitroglicerina é detonada. Considere os seguintes dados: Massa g/mol: H = 1; C = 12; N = 14; O = 16; Constante universal dos gases: R = 8,2 · 10−2 atm · L · K−1 · mol−1; Pressão: 1 atm; Temperatura: 27°C e Volume Molar: 22,4 L . mol-1.
Mediante análise, marque a alternativa que apresenta corretamente o volume aproximado.
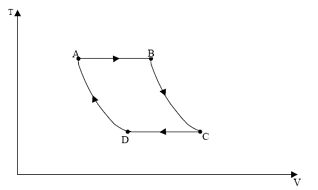
Com base nesse gráfico, é correto afirmar que entre os pontos
Informe se é verdadeiro (V) ou falso (F) o que se afirma abaixo sobre as propriedades termodinâmicas.
( ) Ponto de orvalho é a temperatura na qual se inicia a condensação da mistura.
( ) Ponto de bolha é a temperatura na qual se inicia a ebulição do líquido puro.
( ) Quando a mistura está no ponto de bolha, dizemos que é um líquido insaturado.
( ) Se a mistura estiver aquecida acima do ponto de bolha, dizemos que é vapor superaquecido
A alternativa que apresenta a sequência correta é