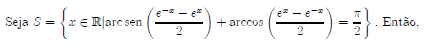Questões Militares
Para aluno do ita
Foram encontradas 869 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Um sistema em equilíbrio é composto por n0 mol de um gás ideal a pressão P0 , volume V0, temperatura T0 e energia interna U0 . Partindo sempre deste sistema em equilíbrio, são realizados isoladamente os seguintes processos:
I. Processo isobárico de T0 até T0/2 .
II. Processo isobárico de V0 até 2V0 .
III. Processo isocórico de P0 até P0/2 .
IV. Processo isocórico de T0 até 2T0 .
V. Processo isotérmico de P0 até P0/2.
VI. Processo isotérmico de V0 até V0 /2 .
Admitindo que uma nova condição de equilíbrio para esse sistema seja atingida em cada processo x ( x = I, II, III, IV, V e VI), assinale a opção que contém a informação ERRADA.
A reação catalisada do triacilglicerol com um álcool (metanol ou etanol) produz glicerol (1,2,3 propanotriol) e uma mistura de ésteres alquílicos de ácidos graxos de cadeia longa, mais conhecido como biodiesel. Essa reação de transesterificação envolve o equilíbrio representado pela seguinte equação química balanceada:
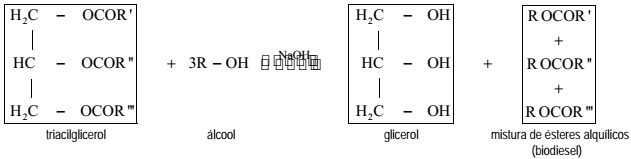
em que: R ', R ", R ''' = cadeias carbônicas dos ácidos graxos e R = grupo alquil do álcool reagente.
A respeito da produção do biodiesel pelo processo de transesterificação, são feitas as seguintes afirmações:
I. O hidróxido de sódio é dissolvido completamente e reage com o agente transesterificante para produzir água e o íon alcóxido.
II. Na transesterificação catalisada por álcali, os reagentes empregados nesse processo devem ser substancialmente anidros para prevenir a formação de sabões.
III. Na reação de produção do biodiesel pela rota etílica, com catalisador alcalino, o alcóxido formado inibe a reação de saponificação.
Das afirmações acima, está(ão) CORRETA(S) apenas
Em um experimento de laboratório, cloreto de alumínio, cloreto de zinco e carbonato de sódio são dissolvidos, individualmente, em três recipientes separados contendo água neutra aerada com pH = 7. Uma placa de ferro metálico é imersa em cada um dos recipientes, que são mantidos à temperatura de 25 °C.
Admitindo-se as condições experimentais apresentadas acima, são feitas as seguintes afirmações em relação à influência da hidrólise dos sais na velocidade de corrosão das placas metálicas:
I. O cátion alumínio hidratado forma soluções aquosas que aceleram a corrosão do ferro.
II. As soluções aquosas produzidas pela hidrólise do ânion carbonato inibem a corrosão do ferro.
III. A corrosão do ferro é inibida pela solução aquosa formada no processo de hidrólise do cátion zinco hidratado.
Das afirmações acima, está(ão) CORRETA(S) apenas
Assinale a opção CORRETA que apresenta o potencial de equilíbrio do eletrodo A l3+ /A l ,em volt, na escala do eletrodo de referência de cobre-sulfato de cobre, à temperatura de 25 °C, calculado para uma concentração do íon alumínio de 10-3 mol-1 .
Dados: Potenciais de eletrodo padrão do cobre-sulfato de cobre
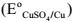 e do alumínio
e do alumínio 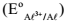 , na escala do
eletrodo de hidrogênio, nas condições-padrão:
, na escala do
eletrodo de hidrogênio, nas condições-padrão: 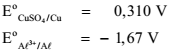
São descritos abaixo dois experimentos, I e II, nos quais há sublimação completa de uma mesma quantidade de dióxido de carbono no estado sólido a 25 °C:
I - O processo é realizado em um recipiente hermeticamente fechado, de paredes rígidas e indeformáveis.
II - O processo é realizado em cilindro provido de um pistão, cuja massa é desprezível e se desloca sem atrito.
A respeito da variação da energia interna do sistema (ΔU), calor (q) e trabalho (w), nos experimentos I e II, assinale a opção que contém a afirmação ERRADA.
Em um experimento eletrolítico, uma corrente elétrica circula através de duas células durante 5 horas. Cada célula contém condutores eletrônicos de platina. A primeira célula contém solução aquosa de íons Au3+ enquanto que, na segunda célula, está presente uma solução aquosa de íons Cu2+ .
Sabendo que 9,85 g de ouro puro foram depositados na primeira célula, assinale a opção que corresponde à massa de cobre, em gramas, depositada na segunda célula eletrolítica.
Considere a energia liberada em
I. combustão completa (estequiométrica) do octano e em
II. célula de combustível de hidrogênio e oxigênio.
Assinale a opção que apresenta a razão CORRETA entre a quantidade de energia liberada por átomo de hidrogênio na combustão do octano e na célula de combustível.
Dados: Energias de ligação, em KJ mol-1:
C – C 347 H – H 436
C – H 413 H – O 464
C = O 803 O = O 498
A 25 °C, as massas específicas do etanol e da água, ambos puros, são 0,8 g cm−3 e 1,0 g cm−3 , respectivamente. Adicionando 72 g de água pura a 928 g de etanol puro, obteve-se uma solução com 1208 cm3 de volume.
Assinale a opção que expressa a concentração desta solução em graus Gay-Lussac (°GL).
A 25 °C, três frascos (I, II e III) contêm, respectivamente, soluções aquosas 0,10 mol L−1 em acetato de sódio, em cloreto de sódio e em nitrito de sódio.
Assinale a opção que apresenta a ordem crescente CORRETA de valores de pHx (x = I,II e III) dessas soluções, sabendo que as constantes de dissociação (K) , a 25 °C, dos ácidos clorídrico (HCl) , nitroso (HNO2) e acético (CH3COOH) , apresentam a seguinte relação:
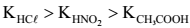
 : segmento de reta unindo os pontos A e B
: segmento de reta unindo os pontos A e B
 : arco de circunferência de extremidades A e B
: arco de circunferência de extremidades A e B
 : segmento de reta unindo os pontos A e B
: segmento de reta unindo os pontos A e B
 : arco de circunferência de extremidades A e B
: arco de circunferência de extremidades A e B
Um cone circular reto de altura 1 cm e geratriz 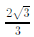 cm é interceptado por um plano paralelo à sua base, sendo determinado, assim, um novo cone. Para que este novo cone tenha o mesmo volume de um cubo de aresta
cm é interceptado por um plano paralelo à sua base, sendo determinado, assim, um novo cone. Para que este novo cone tenha o mesmo volume de um cubo de aresta 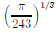 cm, é necessário que a distância do plano à base do cone original seja, em cm, igual a
cm, é necessário que a distância do plano à base do cone original seja, em cm, igual a
 : segmento de reta unindo os pontos A e B
: segmento de reta unindo os pontos A e B
 : arco de circunferência de extremidades A e B
: arco de circunferência de extremidades A e B
 : segmento de reta unindo os pontos A e B
: segmento de reta unindo os pontos A e B
 : arco de circunferência de extremidades A e B
: arco de circunferência de extremidades A e B
 Então, o produto e a soma de todos os possíveis valores de tg(x) são, respectivamente
Então, o produto e a soma de todos os possíveis valores de tg(x) são, respectivamente
 : segmento de reta unindo os pontos A e B
: segmento de reta unindo os pontos A e B
 : arco de circunferência de extremidades A e B
: arco de circunferência de extremidades A e B