Questões Militares
Para aluno do ita
Foram encontradas 869 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Quando precisar use os seguintes valores para as constantes: Constante da gravitação universal G = 7 x 10-11 m3/kg.s2. Aceleraçao da gravidade g = 10 m /s2. Velocidade do som no ar = 340 m/s. Raio da Terra R = 6400 km. Constante dos gases R = 8,3 J/mol.K. Indice adiabatico do ar y = CP/CV = 1,4. Massa molecular do ar Mar = 0,029 kg/mol. Permeabilidade magnetica do vacuo μ0 = 4π x 10-7 N/A2.
Pressão atmosferica 1,0 atm = 100 kPa. Massa específica da agua = 1 ,0 g/cm3
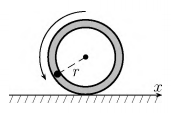
Um tubo fino de massa 1225g e raio r = 10,0 cm encontra-se inicialmente em repouso sobre um plano horizontal sem atrito. A partir do ponto mais alto, um corpo de massa 71,0g com velocidade inicial zero desliza sem atrito pelo interior do tubo no sentido anti-horário, conforme a figura. Entao, quando na posição mais baixa, o corpo terá uma velocidade relativa ao tubo, em cm/s, igual a
Quando precisar use os seguintes valores para as constantes: Constante da gravitação universal G = 7 x 10-11 m3/kg.s2. Aceleraçao da gravidade g = 10 m /s2. Velocidade do som no ar = 340 m/s. Raio da Terra R = 6400 km. Constante dos gases R = 8,3 J/mol.K. Indice adiabatico do ar y = CP/CV = 1,4. Massa molecular do ar Mar = 0,029 kg/mol. Permeabilidade magnetica do vacuo μ0 = 4π x 10-7 N/A2.
Pressão atmosferica 1,0 atm = 100 kPa. Massa específica da agua = 1 ,0 g/cm3
Quando precisar use os seguintes valores para as constantes: Constante da gravitação universal G = 7 x 10-11 m3/kg.s2. Aceleraçao da gravidade g = 10 m /s2. Velocidade do som no ar = 340 m/s. Raio da Terra R = 6400 km. Constante dos gases R = 8,3 J/mol.K. Indice adiabatico do ar y = CP/CV = 1,4. Massa molecular do ar Mar = 0,029 kg/mol. Permeabilidade magnetica do vacuo μ0 = 4π x 10-7 N/A2.
Pressão atmosferica 1,0 atm = 100 kPa. Massa específica da agua = 1 ,0 g/cm3
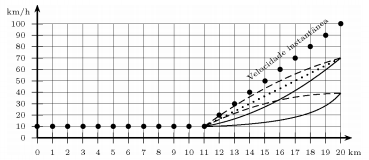
Os pontos no gráfico indicam a velocidade instantánea, quilômetro a quilômetro, de um carro em movimento retilíneo. Por sua vez, o computador de bordo do carro calcula a velocidade média dos últimos 9 km por ele percorridos. Então, a curva que melhor representa a velocidade média indicada no computador de bordo entre os quilômetros 11 e 20 é
Quando precisar use os seguintes valores para as constantes: Constante da gravitação universal G = 7 x 10-11 m3/kg.s2. Aceleraçao da gravidade g = 10 m /s2. Velocidade do som no ar = 340 m/s. Raio da Terra R = 6400 km. Constante dos gases R = 8,3 J/mol.K. Indice adiabatico do ar y = CP/CV = 1,4. Massa molecular do ar Mar = 0,029 kg/mol. Permeabilidade magnetica do vacuo μ0 = 4π x 10-7 N/A2.
Pressão atmosferica 1,0 atm = 100 kPa. Massa específica da agua = 1 ,0 g/cm3
Quando precisar use os seguintes valores para as constantes: Constante da gravitação universal G = 7 x 10-11 m3/kg.s2. Aceleraçao da gravidade g = 10 m /s2. Velocidade do som no ar = 340 m/s. Raio da Terra R = 6400 km. Constante dos gases R = 8,3 J/mol.K. Indice adiabatico do ar y = CP/CV = 1,4. Massa molecular do ar Mar = 0,029 kg/mol. Permeabilidade magnetica do vacuo μ0 = 4π x 10-7 N/A2.
Pressão atmosferica 1,0 atm = 100 kPa. Massa específica da agua = 1 ,0 g/cm3
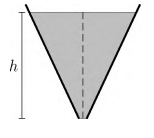
Na figura, o tanque em forma de tronco de cone, com 10,0 cm de raio da base, contém água até o nível de altura h = 500 cm, com 100 cm de raio da superfície livre. Removendo-se a tampa da base, a água começa a escoar e, nesse instante, a pressão no nível a 15,0 cm de altura e de
Quando precisar use os seguintes valores para as constantes: Constante da gravitação universal G = 7 x 10-11 m3/kg.s2. Aceleraçao da gravidade g = 10 m /s2. Velocidade do som no ar = 340 m/s. Raio da Terra R = 6400 km. Constante dos gases R = 8,3 J/mol.K. Indice adiabatico do ar y = CP/CV = 1,4. Massa molecular do ar Mar = 0,029 kg/mol. Permeabilidade magnetica do vacuo μ0 = 4π x 10-7 N/A2.
Pressão atmosferica 1,0 atm = 100 kPa. Massa específica da agua = 1 ,0 g/cm3
Quando precisar use os seguintes valores para as constantes: Constante da gravitação universal G = 7 x 10-11 m3/kg.s2. Aceleraçao da gravidade g = 10 m /s2. Velocidade do som no ar = 340 m/s. Raio da Terra R = 6400 km. Constante dos gases R = 8,3 J/mol.K. Indice adiabatico do ar y = CP/CV = 1,4. Massa molecular do ar Mar = 0,029 kg/mol. Permeabilidade magnetica do vacuo μ0 = 4π x 10-7 N/A2.
Pressão atmosferica 1,0 atm = 100 kPa. Massa específica da agua = 1 ,0 g/cm3
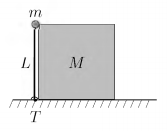
Uma haste vertical de comprimento L, sem peso, e presa a uma articulação T e dispõe em sua extremidade de uma pequena massa m que, conforme a figura, toca levemente a quina de um bloco de massa M . Após uma pequena perturbação, o sistema movimenta-se para a direita. A massa m perde o contato com M no momento em que a haste perfaz um ângulo de π /6 rad com a horizontal. Desconsiderando atritos, assinale a velocidade final do bloco.
Quando precisar use os seguintes valores para as constantes: Constante da gravitação universal G = 7 x 10-11 m3/kg.s2. Aceleraçao da gravidade g = 10 m /s2. Velocidade do som no ar = 340 m/s. Raio da Terra R = 6400 km. Constante dos gases R = 8,3 J/mol.K. Indice adiabatico do ar y = CP/CV = 1,4. Massa molecular do ar Mar = 0,029 kg/mol. Permeabilidade magnetica do vacuo μ0 = 4π x 10-7 N/A2.
Pressão atmosferica 1,0 atm = 100 kPa. Massa específica da agua = 1 ,0 g/cm3
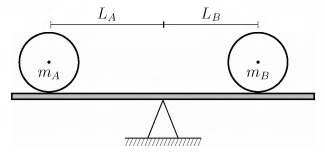
Sobre uma prancha horizontal de massa desprezível e apoiada no centro, dois discos, de massas mA e mB, respectivamente, rolam com as respectivas velocidades vA e vB, constantes, em direção ao centro, do qual distam LA e LB, conforme a figura. Com o sistema em equilíbrio antes que os discos colidam, a razão vA/vB e dada por
Quando precisar use os seguintes valores para as constantes: Constante da gravitação universal G = 7 x 10-11 m3/kg.s2. Aceleraçao da gravidade g = 10 m /s2. Velocidade do som no ar = 340 m/s. Raio da Terra R = 6400 km. Constante dos gases R = 8,3 J/mol.K. Indice adiabatico do ar y = CP/CV = 1,4. Massa molecular do ar Mar = 0,029 kg/mol. Permeabilidade magnetica do vacuo μ0 = 4π x 10-7 N/A2.
Pressão atmosferica 1,0 atm = 100 kPa. Massa específica da agua = 1 ,0 g/cm3
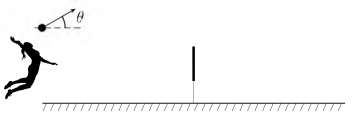
Numa quadra de volei de 18 m de comprimento, com rede de 2,24 m de altura, uma atleta solitária faz um saque com a bola bem em cima da linha de fundo, a 3,0 m de altura, num ângulo θ de 15° com a horizontal, conforme a figura, com trajetória num plano perpendicular a rede. Desprezando o atrito, pode-se dizer que, com 12 m/s de velocidade inicial, a bola
Quando precisar use os seguintes valores para as constantes: Constante da gravitação universal G = 7 x 10-11 m3/kg.s2. Aceleraçao da gravidade g = 10 m /s2. Velocidade do som no ar = 340 m/s. Raio da Terra R = 6400 km. Constante dos gases R = 8,3 J/mol.K. Indice adiabatico do ar y = CP/CV = 1,4. Massa molecular do ar Mar = 0,029 kg/mol. Permeabilidade magnetica do vacuo μ0 = 4π x 10-7 N/A2.
Pressão atmosferica 1,0 atm = 100 kPa. Massa específica da agua = 1 ,0 g/cm3
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

O perclorato de amónio (PA) é um dos componentes mais utilizados em propelentes de foguetes. Para aperfeiçoar seu desempenho, hidrogênio pode ser utilizado como aditivo. Considere dadas as entalpias de combustão destas espécies: ΔHC.PA = -189 kJ mol-1; ΔHC.H2 = -286 kJ mol-1.
Com base nessas informações, assinale a opção que apresenta a equação linear da variação da entalpia de combustão da mistura de PA com H2 em função da quantidade de H2.
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Considere as seguintes semirreações de oxirredução e seus respectivos potenciais padrão na escala do eletrodo padrão de hidrogênio (EPH):
I. 2CO2 + 12H+ + 12e- ⇌ C2H5OH + 3H2O E°I = 0,085V
II. O2 + 4H+ + 4e- ⇌ 2H2O E°II = 1,229V
Assinale a opção que apresenta a afirmação ERRADA sobre uma célula eletroquímica em que a semirreação I ocorre no anodo e a semirreação II, no catodo.
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Considere dadas as constantes de dissociação ácida (Ka) ou básica (Kb) das seguintes substâncias, a 25°C: fenol (C6H5OH), Ka= 1 x 10-10 e anilina (C6H5NH2), Kb = 7 x 10-10.
Sobre o pH de soluções aquosas dessas substâncias são feitas as seguintes afirmações:
I. A solução aquosa de fenol a 1 x 10-4 mol L-1 tem pH<5.
II. A solução aquosa de anilina a 1 x 10-4 mol L-1 tem pH>9.
III. Ambas as soluções aquosas a 1 x 10-4 mol L-1 têm pH aproximadamente iguais.
Das afirmações acima está(ão) CORRETA(S)
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

São feitas as seguintes proposições a respeito de propriedades coligativas:
I. A pressão osmótica depende do tipo de solvente para um dado soluto.
II. A criometria usa o abaixamento do ponto de congelamento do solvente para medir a massa molar do
soluto.
III. Na ebuliometria, a variação da temperatura de ebulição depende da concentração molal de soluto não volátil utilizado.
IV. Na tonometria, ocorre abaixamento da pressão de vapor de uma solução que contém um soluto não volátil, em relação ao solvente puro.
Das proposições acima é(são) CORRETA(S)
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Um recipiente de paredes adiabáticas e de volume constante contém duas amostras de água pura separadas por uma parede também adiabática e de volume desprezível. Uma das amostras consiste em 54 g de água a 25 °C e, a outra, em 126 g a 75 °C. Considere que a parede que separa as amostras é retirada e que as amostras de água se misturam até atingir o equilíbrio. Sobre esse processo são feitas as seguintes afirmações:
I. A temperatura da mistura no equilíbrio é de 323 K.
II. A variação de entalpia no processo é nula.
III. A variação de energia interna no processo é nula.
IV. A variação de entropia no processo é nula.
Assinale a opção que apresenta a(s) afirmação(ões) CORRETA(S) sobre a mistura das amostras de água.
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Considere as seguintes proposições:
I. A propriedade básica associada ao fracionamento do petróleo é o ponto de ebulição.
II. Em geral, no craqueamento térmico do petróleo ocorre formação de radicais livres por meio da quebra de ligação homolítica, enquanto que no craqueamento catalítico ocorre a ruptura heterolítica.
III. Metano não é produzido na destilação fracionada do petróleo.
IV. Indústria petroquímica é o termo utilizado para designar o ramo da indústria química que utiliza derivados de petróleo como matéria-prima para a fabricação de novos materiais, como medicamentos, fertilizantes e explosivos.
V. Os rendimentos de derivados diretos do petróleo no processo de destilação fracionada não dependem do tipo de petróleo utilizado.
Das proposições acima são CORRETAS