Questões Militares
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 151 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A sim-trimetilenotrinitramina (C3 H6 N6 O6 ), também conhecida como RDX ou ciclonita, é um poderoso explosivo utilizado na fabricação de minas, cargas de profundidade e em torpedos, entre outros.
Sua estrutura química é apresentada a seguir.
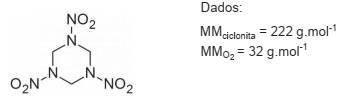
A detonação de um explosivo é uma reação de oxidação, provocada por impacto ou por ação do calor. Quando a quantidade de oxigênio presente na molécula do explosivo é insuficiente para que a oxidação completa ocorra, parte do oxigênio provém de fontes externas, como o ar atmosférico. O balanço de oxigênio para a molécula de explosivo fornece a fração de oxigênio, em percentual mássico, insuficiente ou excedente, que a molécula apresenta relativamente à quantidade necessária para a sua oxidação completa.
No caso da ciclonita, esse percentual é de
O módulo de descida lunar da Apoio utilizou a dimetil-hidrazina (CH3)2NNH2 como combustível juntamente com o N2O4 líquido como oxidante. A reação química entre os dois reagentes no motor do foguete ocorre conforme descrito na equação química balanceada a seguir:
(CH3)2NNH2 + 2N2O4 → 4H2O + 2CO2 + 3N2
Na figura abaixo, "MO” representa um óxido de um elemento do Grupo 2 da Tabela Periódica. Assinale a opção que identifica corretamente os elementos “A”, “B”, “C" e "D”, respectivamente.
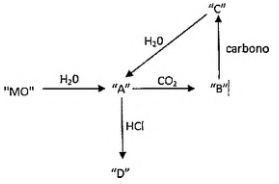
A fórmula mínima desse óxido é:
Dados: massa atômica de cobre 64 u ; volume molar nas CNTP: 22,7 L

I – O agente oxidante dessa reação é o O2.
II – O coeficiente estequiométrico da água, após o balanceamento da equação, é 2.
III – Considerando a densidade do etanol 0,8 g/mL (25 ºC; 1 atm), a combustão completa de 1150 mL desse composto libera aproximadamente 27360 kJ.
IV – A quantidade de calor liberada na combustão de 1 mol de etanol é de 278 kJ·mol-1.
Das afirmativas feitas estão corretas apenas
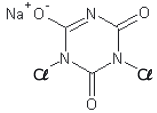
dicloro isocianurato de sódio
Considerando a estrutura apresentada e o texto, são feitas as seguintes afirmativas:
I – em sua estrutura encontra-se o grupo funcional representativo da função nitrocomposto. II – todos os carbonos apresentados na estrutura possuem hibridização sp2. III – sua fórmula molecular é C3Cl2N3NaO3. IV – Considerando-se um cantil operacional contendo 1000 mL de água, será necessário mais que uma unidade do comprimido para desinfecção completa dessa água.
Das afirmativas feitas estão corretas apenas:
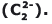
(FONSECA, Martha Reis Marques da, Química Geral, São Paulo: Ed FTD, 2007, pág 330)
O carbeto de cálcio (CaC2), também denominado de carbureto ou acetileto de cálcio, é um sólido duro que reage com a água para produção do gás acetileno (C2H2). A reação que se processa é representada pela seguinte equação não balanceada: CaC2 + H2O C2H2 + Ca(OH)2
Com relação a esta reação, seus reagentes e produtos, são feitas as seguintes afirmativas:
I – o carbeto de cálcio é um composto iônico. II – a nomenclatura oficial da União Internacional de Química Pura e Aplicada (IUPAC) para o acetileno (C2H2) é etino. III – o Ca(OH)2 é classificado como uma base de Arrhenius e tem nomenclatura de hidróxido de cálcio. IV – a soma dos coeficientes da equação corretamente balanceada é 5. V – todos os reagentes e produtos são classificados como substâncias simples.
Dado: número atômico (Z) H = 1; O = 8; Ca = 20; C = 6
Estão corretas apenas as afirmativas
Considere as seguintes equações de neutralização total representadas abaixo.
A maior parte da produção de amônia, nos dias atuais, é utilizada para a produção de fertilizantes. Esse processo é conhecido como Haber-Bosch. Parte de nitrogênio (N2) e Hidrogênio (H2) formando a amônia (NH3). A reação é executada entre 400 e 450° C e 600 atm (atmosferas) e pode ser representada pela equação abaixo.
______ N2(g) + ______ H2(g) ⇔ ______ NH3(g)
Assinale a alternativa que completa correta e respectivamente as lacunas nos balanceamentos da reação acima.
Em condições ideais, pequenas quantidades de gás cloro podem ser geradas em laboratório pela reação do óxido de manganês (MnO2 ) com ácido clorídrico (HCl), conforme a equação química a seguir não balanceada.
HCl(aq) + MnO2 (s) → H2O(L) + MnCl2(s) + Cl2(g)
A partir dessas informações, quantas moléculas de gás cloro, aproximadamente, podem ser produzidas quando 10 g de óxido de manganês com grau de pureza de 87% são colocados para reagir completamente com excesso de ácido clorídrico?
Dado: Número de Avogadro (N) = 6 x 1023
Marque a proporção correta abaixo que obedece à lei de Gay-Lussac para os seguintes volumes que participam de uma reação química e que foram medidos em condições idênticas de pressão e temperatura:
1,36LN2 + 4.08L H2 → 2,72L NH3
A pólvora é material empregado como propulsor em armas de fogo. Basicamente, a ideia é provocar uma reação que gere uma quantidade grande de gases sob pressão e temperatura elevadas. Ao se expandirem, esses gases impulsionam um projétil. A pólvora negra, empregada em armas mais antigas, é constituída por uma mistura de salitre (KNO3), enxofre (S) e material de carbono (C). A equação não balanceada de uma das reações químicas que ocorrem durante a queima da pólvora é apresentada a seguir.
KNO3 (s) + S (s) + C (s) → K2S (s) + N2 (g) + CO2 (g)
Considerando essas informações e sabendo que o número atômico do carbono é igual a 6, julgue o item que se segue.
A menor soma de coeficientes estequiométricos inteiros que
permitem balancear a equação química apresentada é igual a 8.
A pólvora é material empregado como propulsor em armas de fogo. Basicamente, a ideia é provocar uma reação que gere uma quantidade grande de gases sob pressão e temperatura elevadas. Ao se expandirem, esses gases impulsionam um projétil. A pólvora negra, empregada em armas mais antigas, é constituída por uma mistura de salitre (KNO3), enxofre (S) e material de carbono (C). A equação não balanceada de uma das reações químicas que ocorrem durante a queima da pólvora é apresentada a seguir.
KNO3 (s) + S (s) + C (s) → K2S (s) + N2 (g) + CO2 (g)
Considerando essas informações e sabendo que o número atômico do carbono é igual a 6, julgue o item que se segue.
Entre os produtos da reação química apresentada, podem ser
identificadas uma substância iônica e duas substâncias
moleculares; entre as substâncias moleculares, uma é polar e,
a outra, apolar.
Com relação a reações químicas e a substâncias, julgue o item subsequente.
No balanceamento de uma equação química, o número
de substâncias no reagente tem que ser igual ao número
de substâncias no produto.
Acerca dos diferentes tipos de ligações químicas e das substâncias formadas em reações químicas, julgue o próximo item.
Nas moléculas, os átomos das substâncias são organizados
linearmente de acordo com sua fórmula molecular.