Questões Militares
Nível médio
Foram encontradas 45.670 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Texto 2A1-I
Olhe para a tomada mais próxima, para um conjunto de janelas ou então para a traseira de um carro. Se você vê figuras parecidas com rostos nesses e em outros objetos, saiba que não é o único: trata-se de um fenômeno bem conhecido pela ciência, chamado pareidolia. Basta posicionar duas formas que lembrem olhos acima de outra que pareça uma boca para as pessoas começarem a enxergar rostos.
A pareidolia já foi vista como um sinal de psicose no passado, mas hoje se sabe que ela é uma tendência completamente normal entre humanos. De acordo com o cientista Carl Sagan, a tendência está provavelmente associada à necessidade evolutiva de reconhecer rostos rapidamente.
Pense na pré-história: se uma pessoa conseguisse identificar os olhos e a boca de um predador escondido na mata, ela teria mais chances de fugir e sobreviver. Quem tivesse dificuldade em ver um rosto camuflado ali provavelmente seria pego de surpresa — e consequentemente viraria jantar.
Pesquisadores da Universidade de Nova Gales do Sul, na Austrália, investigaram o fenômeno e escreveram em um artigo que, além da vantagem evolutiva, a pareidolia também pode estar relacionada ao mecanismo do cérebro que reconhece e processa informações sociais em outras pessoas. “Não basta perceber a presença de um rosto; precisamos reconhecer quem é aquela pessoa, ler as informações presentes no rosto, se ela está prestando atenção em nós, e se está feliz ou triste”, diz o líder do estudo.
De fato, os objetos inanimados não parecem ser apenas rostos inexpressivos. Em uma simples caminhada na rua, você pode ter a impressão de que semáforos, carros, casas e até tijolos jogados na calçada te encaram e parecem esboçar expressões faciais — medo, raiva, alegria, susto ou tristeza.
Segundo os autores do estudo, os objetos são, de fato, interpretados como rostos humanos pelo nosso cérebro. “Nós sabemos que o objeto não tem uma mente, mas não conseguimos evitar olhar para ele como se tivesse características inteligentes, como direção do olhar ou emoções; isso acontece porque os mecanismos ativados pelo nosso sistema visual são os mesmos quando vemos um rosto real ou um objeto com características faciais”, diz um dos pesquisadores.
Os cientistas pretendem também investigar os mecanismos cognitivos que levam ao oposto: a prosopagnosia (a inabilidade de identificar rostos) ou algumas manifestações do espectro autista, o que inclui a dificuldade em ler rostos e interpretar as informações presentes neles, como o estado emocional.
Maria Clara Rossini. Pareidolia: por que vemos “rostos” em objetos
inanimados? Este estudo explica. Internet: <super.abril.com.br> (com adaptações).
Texto 2A1-I
Olhe para a tomada mais próxima, para um conjunto de janelas ou então para a traseira de um carro. Se você vê figuras parecidas com rostos nesses e em outros objetos, saiba que não é o único: trata-se de um fenômeno bem conhecido pela ciência, chamado pareidolia. Basta posicionar duas formas que lembrem olhos acima de outra que pareça uma boca para as pessoas começarem a enxergar rostos.
A pareidolia já foi vista como um sinal de psicose no passado, mas hoje se sabe que ela é uma tendência completamente normal entre humanos. De acordo com o cientista Carl Sagan, a tendência está provavelmente associada à necessidade evolutiva de reconhecer rostos rapidamente.
Pense na pré-história: se uma pessoa conseguisse identificar os olhos e a boca de um predador escondido na mata, ela teria mais chances de fugir e sobreviver. Quem tivesse dificuldade em ver um rosto camuflado ali provavelmente seria pego de surpresa — e consequentemente viraria jantar.
Pesquisadores da Universidade de Nova Gales do Sul, na Austrália, investigaram o fenômeno e escreveram em um artigo que, além da vantagem evolutiva, a pareidolia também pode estar relacionada ao mecanismo do cérebro que reconhece e processa informações sociais em outras pessoas. “Não basta perceber a presença de um rosto; precisamos reconhecer quem é aquela pessoa, ler as informações presentes no rosto, se ela está prestando atenção em nós, e se está feliz ou triste”, diz o líder do estudo.
De fato, os objetos inanimados não parecem ser apenas rostos inexpressivos. Em uma simples caminhada na rua, você pode ter a impressão de que semáforos, carros, casas e até tijolos jogados na calçada te encaram e parecem esboçar expressões faciais — medo, raiva, alegria, susto ou tristeza.
Segundo os autores do estudo, os objetos são, de fato, interpretados como rostos humanos pelo nosso cérebro. “Nós sabemos que o objeto não tem uma mente, mas não conseguimos evitar olhar para ele como se tivesse características inteligentes, como direção do olhar ou emoções; isso acontece porque os mecanismos ativados pelo nosso sistema visual são os mesmos quando vemos um rosto real ou um objeto com características faciais”, diz um dos pesquisadores.
Os cientistas pretendem também investigar os mecanismos cognitivos que levam ao oposto: a prosopagnosia (a inabilidade de identificar rostos) ou algumas manifestações do espectro autista, o que inclui a dificuldade em ler rostos e interpretar as informações presentes neles, como o estado emocional.
Maria Clara Rossini. Pareidolia: por que vemos “rostos” em objetos
inanimados? Este estudo explica. Internet: <super.abril.com.br> (com adaptações).
Texto 2A1-I
Olhe para a tomada mais próxima, para um conjunto de janelas ou então para a traseira de um carro. Se você vê figuras parecidas com rostos nesses e em outros objetos, saiba que não é o único: trata-se de um fenômeno bem conhecido pela ciência, chamado pareidolia. Basta posicionar duas formas que lembrem olhos acima de outra que pareça uma boca para as pessoas começarem a enxergar rostos.
A pareidolia já foi vista como um sinal de psicose no passado, mas hoje se sabe que ela é uma tendência completamente normal entre humanos. De acordo com o cientista Carl Sagan, a tendência está provavelmente associada à necessidade evolutiva de reconhecer rostos rapidamente.
Pense na pré-história: se uma pessoa conseguisse identificar os olhos e a boca de um predador escondido na mata, ela teria mais chances de fugir e sobreviver. Quem tivesse dificuldade em ver um rosto camuflado ali provavelmente seria pego de surpresa — e consequentemente viraria jantar.
Pesquisadores da Universidade de Nova Gales do Sul, na Austrália, investigaram o fenômeno e escreveram em um artigo que, além da vantagem evolutiva, a pareidolia também pode estar relacionada ao mecanismo do cérebro que reconhece e processa informações sociais em outras pessoas. “Não basta perceber a presença de um rosto; precisamos reconhecer quem é aquela pessoa, ler as informações presentes no rosto, se ela está prestando atenção em nós, e se está feliz ou triste”, diz o líder do estudo.
De fato, os objetos inanimados não parecem ser apenas rostos inexpressivos. Em uma simples caminhada na rua, você pode ter a impressão de que semáforos, carros, casas e até tijolos jogados na calçada te encaram e parecem esboçar expressões faciais — medo, raiva, alegria, susto ou tristeza.
Segundo os autores do estudo, os objetos são, de fato, interpretados como rostos humanos pelo nosso cérebro. “Nós sabemos que o objeto não tem uma mente, mas não conseguimos evitar olhar para ele como se tivesse características inteligentes, como direção do olhar ou emoções; isso acontece porque os mecanismos ativados pelo nosso sistema visual são os mesmos quando vemos um rosto real ou um objeto com características faciais”, diz um dos pesquisadores.
Os cientistas pretendem também investigar os mecanismos cognitivos que levam ao oposto: a prosopagnosia (a inabilidade de identificar rostos) ou algumas manifestações do espectro autista, o que inclui a dificuldade em ler rostos e interpretar as informações presentes neles, como o estado emocional.
Maria Clara Rossini. Pareidolia: por que vemos “rostos” em objetos
inanimados? Este estudo explica. Internet: <super.abril.com.br> (com adaptações).
Texto 2A1-I
Olhe para a tomada mais próxima, para um conjunto de janelas ou então para a traseira de um carro. Se você vê figuras parecidas com rostos nesses e em outros objetos, saiba que não é o único: trata-se de um fenômeno bem conhecido pela ciência, chamado pareidolia. Basta posicionar duas formas que lembrem olhos acima de outra que pareça uma boca para as pessoas começarem a enxergar rostos.
A pareidolia já foi vista como um sinal de psicose no passado, mas hoje se sabe que ela é uma tendência completamente normal entre humanos. De acordo com o cientista Carl Sagan, a tendência está provavelmente associada à necessidade evolutiva de reconhecer rostos rapidamente.
Pense na pré-história: se uma pessoa conseguisse identificar os olhos e a boca de um predador escondido na mata, ela teria mais chances de fugir e sobreviver. Quem tivesse dificuldade em ver um rosto camuflado ali provavelmente seria pego de surpresa — e consequentemente viraria jantar.
Pesquisadores da Universidade de Nova Gales do Sul, na Austrália, investigaram o fenômeno e escreveram em um artigo que, além da vantagem evolutiva, a pareidolia também pode estar relacionada ao mecanismo do cérebro que reconhece e processa informações sociais em outras pessoas. “Não basta perceber a presença de um rosto; precisamos reconhecer quem é aquela pessoa, ler as informações presentes no rosto, se ela está prestando atenção em nós, e se está feliz ou triste”, diz o líder do estudo.
De fato, os objetos inanimados não parecem ser apenas rostos inexpressivos. Em uma simples caminhada na rua, você pode ter a impressão de que semáforos, carros, casas e até tijolos jogados na calçada te encaram e parecem esboçar expressões faciais — medo, raiva, alegria, susto ou tristeza.
Segundo os autores do estudo, os objetos são, de fato, interpretados como rostos humanos pelo nosso cérebro. “Nós sabemos que o objeto não tem uma mente, mas não conseguimos evitar olhar para ele como se tivesse características inteligentes, como direção do olhar ou emoções; isso acontece porque os mecanismos ativados pelo nosso sistema visual são os mesmos quando vemos um rosto real ou um objeto com características faciais”, diz um dos pesquisadores.
Os cientistas pretendem também investigar os mecanismos cognitivos que levam ao oposto: a prosopagnosia (a inabilidade de identificar rostos) ou algumas manifestações do espectro autista, o que inclui a dificuldade em ler rostos e interpretar as informações presentes neles, como o estado emocional.
Maria Clara Rossini. Pareidolia: por que vemos “rostos” em objetos
inanimados? Este estudo explica. Internet: <super.abril.com.br> (com adaptações).
Texto 2A1-I
Olhe para a tomada mais próxima, para um conjunto de janelas ou então para a traseira de um carro. Se você vê figuras parecidas com rostos nesses e em outros objetos, saiba que não é o único: trata-se de um fenômeno bem conhecido pela ciência, chamado pareidolia. Basta posicionar duas formas que lembrem olhos acima de outra que pareça uma boca para as pessoas começarem a enxergar rostos.
A pareidolia já foi vista como um sinal de psicose no passado, mas hoje se sabe que ela é uma tendência completamente normal entre humanos. De acordo com o cientista Carl Sagan, a tendência está provavelmente associada à necessidade evolutiva de reconhecer rostos rapidamente.
Pense na pré-história: se uma pessoa conseguisse identificar os olhos e a boca de um predador escondido na mata, ela teria mais chances de fugir e sobreviver. Quem tivesse dificuldade em ver um rosto camuflado ali provavelmente seria pego de surpresa — e consequentemente viraria jantar.
Pesquisadores da Universidade de Nova Gales do Sul, na Austrália, investigaram o fenômeno e escreveram em um artigo que, além da vantagem evolutiva, a pareidolia também pode estar relacionada ao mecanismo do cérebro que reconhece e processa informações sociais em outras pessoas. “Não basta perceber a presença de um rosto; precisamos reconhecer quem é aquela pessoa, ler as informações presentes no rosto, se ela está prestando atenção em nós, e se está feliz ou triste”, diz o líder do estudo.
De fato, os objetos inanimados não parecem ser apenas rostos inexpressivos. Em uma simples caminhada na rua, você pode ter a impressão de que semáforos, carros, casas e até tijolos jogados na calçada te encaram e parecem esboçar expressões faciais — medo, raiva, alegria, susto ou tristeza.
Segundo os autores do estudo, os objetos são, de fato, interpretados como rostos humanos pelo nosso cérebro. “Nós sabemos que o objeto não tem uma mente, mas não conseguimos evitar olhar para ele como se tivesse características inteligentes, como direção do olhar ou emoções; isso acontece porque os mecanismos ativados pelo nosso sistema visual são os mesmos quando vemos um rosto real ou um objeto com características faciais”, diz um dos pesquisadores.
Os cientistas pretendem também investigar os mecanismos cognitivos que levam ao oposto: a prosopagnosia (a inabilidade de identificar rostos) ou algumas manifestações do espectro autista, o que inclui a dificuldade em ler rostos e interpretar as informações presentes neles, como o estado emocional.
Maria Clara Rossini. Pareidolia: por que vemos “rostos” em objetos
inanimados? Este estudo explica. Internet: <super.abril.com.br> (com adaptações).
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

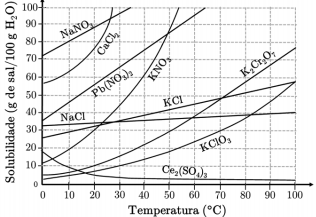
I. Dissolvendo-se 130 g de KNO3 em 200 g de água, a 40 °C, obteremos uma solução saturada com depósito de 70 g desta substância que não será dissolvida. II. Se dissolvermos 20 g de Ce2(SO4)3 em 300 g de água a 10 °C e, posteriormente, aquecermos esta solução a 90 °C, haverá gradativa precipitação da substância. III. A menor quantidade de água necessária para dissolver completamente 140 g de K2Cr2O7 a 90 °C é, aproximadamente, 150 g. IV. NaNO3 é a substância mais solúvel a 30 °C.
Das afirmações acima, está(ão) CORRETA(S)
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) O volume da solução de permanganato de potássio gasto na titulação foi de 100 mL. (2) O menor coeficiente estequiométrico inteiro para Fe2+ na reação redox balanceada é 7. (3) No ponto final, o volume total da solução será de 120 mL. (4) Um precipitado sólido de cor esverdeada será observado como produto dessa reação. (5) O número total de elétrons envolvidos na reação redox é 22 milimols. (6) A razão entre os volumes do titulante e do titulado no ponto final é 2,1.
A soma dos números associados às afirmações CORRETAS é igual a
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) A intensidade da luz depende da frequência ou do comprimento de onda da radiação empregada. (2) Dentre as cores do espectro visível, a azul é a que possui maior intensidade devido ao seu menor comprimento de onda. (3) Dentro do espectro visível, a luz vermelha é a radiação que possui o menor comprimento de onda. (4) O estado do elétron em um átomo é completamente definido pelos números quânticos n, l, ml . (5) A configuração eletrônica dos átomos é determinada pelo princípio da construção, pelo princípio da exclusão de Pauli e pela regra de Hund. (6) Na tabela periódica, os pares de elementos com relação diagonal geralmente exibem propriedades químicas semelhantes.
A soma dos números associados às sentenças ERRADAS é igual a
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) O ponto de fusão do argônio é menor que o do xenônio em uma mesma pressão. (2) A pressão de vapor do dimetilpropano é maior que a do pentano. (3) O valor absoluto da energia potencial de interação entre a molécula de água e o Ca2+ é menor do que entre a molécula de água e o Al3+ . (4) O valor absoluto da energia potencial de interação entre a molécula de água e o Ga3+ é maior do que entre a molécula de água e o Al3+ .
A soma dos números associados às proposições ERRADAS é igual a
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

I. A entropia permanece constante em um sistema fechado que sofre a ação de um processo reversível. II. A variação de entropia é nula dentro do sistema quando ele opera em um ciclo de Carnot. III. O valor absoluto da variação da energia interna de um gás ideal numa expansão reversível adiabática é maior que numa expansão reversível isotérmica. IV. Energia interna é uma propriedade cuja variação pode ser medida pelo trabalho adiabático realizado entre dois estados.
Das afirmações acima, está(ão) ERRADA(S) apenas
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

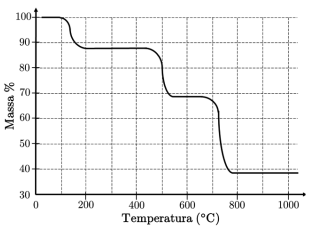
Com base nessa figura e sabendo que a massa inicial corresponde a 100%, é ERRADO afirmar que
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

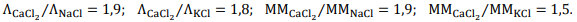
Com base nessas informações, assinale a opção CORRETA entre as condutividades das soluções.
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

I. O comprimento de ligação e a energia de ligação são influenciados pela multiplicidade da ligação, pela ressonância e pelo raio atômico. II. Cargas formais consideram ligações químicas perfeitamente covalentes ao assumir que os elétrons são igualmente compartilhados. III. O poder de polarização de um cátion é maior quanto maiores forem o seu volume e a sua carga. A interação deste cátion com um ânion altamente polarizável tende a apresentar um maior caráter covalente. IV. Na ressonância há uma diminuição da energia em função da contribuição de estruturas que possuem a mesma geometria, porém com diferentes arranjos dos elétrons.
Das afirmações acima, está(ão) ERRADA(S) apenas
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

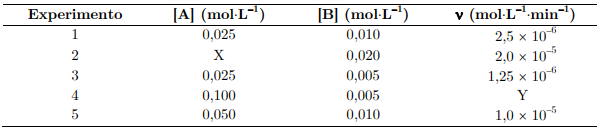
Com base nesses experimentos, assinale a opção que apresenta os valores corretos de α, β, k, X e Y, respectivamente.
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

I. Penteno e ciclopentano não são isômeros estruturais, enquanto butano e ciclobutano são. II. Cloroeteno pode sofrer polimerização por adição, enquanto o tetrafluoretano não. III. 2-Bromopropano é opticamente ativo, enquanto 1,2-dicloropentano não é. IV. Sob exposição à luz, a reação entre cloro e metano ocorre por substituição. Por outro lado, na ausência de luz, a reação entre bromo e eteno ocorre por adição. V. A desidratação intramolecular de álcoois orgânicos forma alcenos.
Das afirmações acima, está(ão) CORRETA(S) apenas
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio


Sabe-se que a bateria converte Pb e PbO2 em PbSO4 na descarga e que, em condições normais, o pH da solução eletrolítica é menor que 1.
A respeito dessa bateria, foram feitas as seguintes afirmações:
I. Em condições normais, durante a descarga, a semirreação principal que ocorre no ânodo é a i e, no cátodo, é a iv. II. Em condições normais, o potencial da bateria no equilíbrio pode ser representado por E = 1,93 − 0,06pH + 0,06log
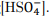 III. Em condições padrão, a eletrólise da água sempre acontece.
IV. Em pH ∼ 2, os potenciais das semirreações secundárias igualam-se aos potenciais das semirreações
principais do ânodo e do cátodo, respectivamente, portanto a eletrólise da água não ocorre
quando o eletrólito tem pH > 2.
III. Em condições padrão, a eletrólise da água sempre acontece.
IV. Em pH ∼ 2, os potenciais das semirreações secundárias igualam-se aos potenciais das semirreações
principais do ânodo e do cátodo, respectivamente, portanto a eletrólise da água não ocorre
quando o eletrólito tem pH > 2. Considerando apenas argumentos baseados no equilíbrio termodinâmico a 25 °C, está(ão) ERRADA(S) apenas a(s) afirmação(ões)
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio
