Questões de Concurso
Sobre gás ideal em física
Foram encontradas 85 questões

Sobre o ciclo Diesel ideal, analise as seguintes assertivas:
I. A temperatura do gás é maior no ponto C.
II. O gás recebe energia na forma de calor durante a transformação 2 e cede calor durante a transformação 4.
III. O gás realiza trabalho durante as transformações 2 e 3.
Quais estão corretas?
Nesse caso, Q, W, e ΔU são tais que
A menor quantidade de calor capaz de fazer essa massa gasosa sofrer esse acréscimo de 20 oC na temperatura é
A figura representa, num diagrama pxV, o ciclo I, II, III, IV e V de um gás ideal.

A maior temperatura do gás durante o ciclo ocorreu em
I. Conforme a Lei Geral dos Gases Ideais, o produto da pressão pelo volume dividido pela temperatura é diretamente proporcional ao número de mols contidos em um gás em equilíbrio termodinâmico.
II. Um gás ideal que sofre uma expansão pode ter sua temperatura reduzida mesmo recebendo energia na forma de calor.
III. A escala de temperatura Kelvin é a mesma escala Celsius, mas com o zero deslocado para o zero absoluto.
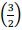 = 0,41 e In
= 0,41 e In 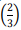 = −0.41.
= −0.41. Nesse caso, a temperatura do gás, em grau Kelvin,
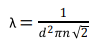
onde λ é o livre caminho médio; d é o diâmetro da molécula; n é a densidade das moléculas no meio (moléculas/m3 ).
Considere uma amostra de oxigênio a 27 ºC e 1 atm (101,3×103 Pa). Calcule o livre caminho médio da molécula de oxigênio, considerando o sistema como um gás ideal e que o tamanho da molécula de oxigênio é de 2,9 Å.
Dados: Constante de Boltzmann k = 1,381×10-23 J.K-1.
O valor calculado é, aproximadamente,
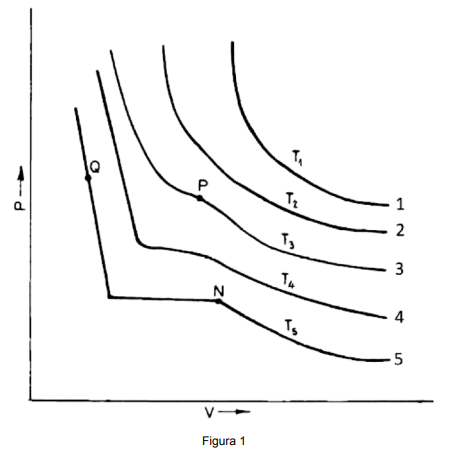
Assinale V (verdadeiro) ou F (falso) diante de cada afirmativa a seguir.
( ) As curvas 1 e 2 seguem a Lei de Boyle para um gás ideal.
( ) O ponto P é conhecido como Ponto Triplo
( ) O ponto N é chamado de Ponto Crítico.
( ) O material no ponto Q está em estado líquido.
Assinale a alternativa com a sequência correta.
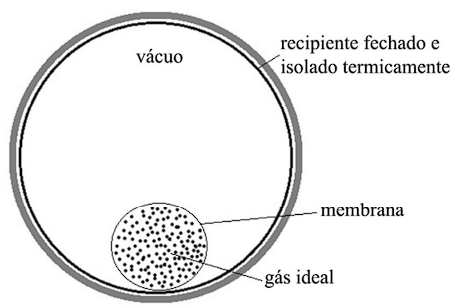
Tendo como referência a figura precedente, que representa um recipiente fechado e isolado termicamente, julgue o item a seguir.
No processo de expansão do gás ideal em razão do
rompimento da membrana, que ocorre dentro de um recipiente
rígido, fechado e isolado termicamente, a temperatura do gás
diminui.
Tendo como referência a figura precedente, que representa um recipiente fechado e isolado termicamente, julgue o item a seguir.
Quando submetido a condições de alta pressão e alta
temperatura, o comportamento de um gás real tende a se
aproximar ao de um gás ideal.
Conforme as leis da termodinâmica básica, julgue o seguinte item.
Considere-se que o volume de um gás ideal tenha diminuído
0,1 m3
devido a uma compressão isobárica sob a pressão de
103
N/m2
e que, durante esse processo, o gás tenha perdido
103
J de calor. Nessa situação, a variação da energia interna
do gás foi superior a 900 J.
A expansão rápida de um gás caracteriza uma transformação adiabática quando ocorre o resfriamento do gás sem que haja tempo para perdas de calor. Sua aplicação em refrigeradores é bastante conhecida, bem como efeitos cotidianos como no ar que sai das latas de spray é mais frio, quando assopramos as mãos, e em inúmeros processos ligados aos fenômenos atmosféricos.
Considere uma quantidade fixa de um gás ideal que passa por uma expansão adiabática e tem sua temperatura reduzida pela metade. Assinale a alternativa que indica a melhor aproximação para a razão entre os volumes final e inicial (V2 / V1), necessária.

A função de distribuição de magnitude de velocidades possíveis de um gás hipotético é expresso por 𝐹(𝑣) = . Tendo em vista que esse gás obedece à relação de Boltzmann, 𝑆 = 𝑘𝐵 𝑙𝑛(𝐹(𝑣)), qual expressão representa a variação de entropia que o sistema sofre ao passar do estado de equilíbrio 3. 𝑣0 para o estado, também de equilíbrio, 2. 𝑣0?
A primeira lei da termodinâmica, associada ao conceito de energia, pode ser expressa pela diferença entre o calor absorvido e o trabalho realizado nos processos termodinâmicos.
Um gás ideal no estado inicial está com pressão de 3 atm, volume de 1 L e energia interna de 456 J, após sofrer dois processos sucessivos: um isobárico, até atingir o volume de 3 L, e outro isocórico, até atingir o estado final com pressão de 2 atm, volume de 3 L e energia interna de 912 J.
Considerando que 1 atm . L = 100,0 J, assinale a alternativa que indica qual o calor trocado durante o processo, em Joules (J).