Questões de Concurso
Sobre gás ideal em física
Foram encontradas 82 questões
Uma câmara hiperbárica é um compartimento selado, de volume constante, onde uma pessoa é submetida a pressões maiores do que a atmosférica. Considere uma câmara hiperbárica com n1 mols de ar, inicialmente a 1,00 x 105 Pa de pressão, a 300 K. Uma quantidade de ar foi injetada na câmara, que passou a ter n2 mols à pressão de 6,00 x 105 Pa, a 330 K.
Considerando o ar um gás ideal, a razão
madamente, 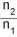 vale, aproximadamente.
vale, aproximadamente.
Um gás ideal de Van der Waals é caracterizado por duas
equações de estado, que consistem em um melhoramento em
relação às equações de um gás ideal, quanto à correta descrição de
gases reais de mais alta densidade. As equações de estado do gás
ideal de Van der Waals podem ser expressas da seguinte maneira:
 em que P corresponde à pressão,
T, à temperatura, V, ao volume, U, à energia interna e N, ao número
de moles.
em que P corresponde à pressão,
T, à temperatura, V, ao volume, U, à energia interna e N, ao número
de moles.
A constante universal dos gases é  e c, a
e b são constantes que dependem da natureza específica do
gás. Para um gás de oxigênio O2, por exemplo, tem-se c = 2,5;
a = 0,138 Pa.m6
e b = 32,6 x 10-6 m3
.
e c, a
e b são constantes que dependem da natureza específica do
gás. Para um gás de oxigênio O2, por exemplo, tem-se c = 2,5;
a = 0,138 Pa.m6
e b = 32,6 x 10-6 m3
.
O Gás Natural Veicular é mais seguro do que qualquer combustível líquido. Outro fator de segurança na utilização do GNV é que, no momento do abastecimento do veículo no Posto, o mesmo é feito sem que haja contato com o ar, evitando assim qualquer possibilidade de combustão. Os cilindros de armazenamento de GNV são dimensionados para suportar a alta pressão na qual o gás é comprimido, que é de:
Considere que em uma brincadeira de colegas, eles sugam pela boca gás hélio e cantam parabéns para uma outra colega da turma.
A voz dos colegas se modifica, nesse caso, porque:
Considere que dois mols de um gás ideal monoatômico estão contidos em um dado recipiente que passa por uma transformação isobárica com pressão de 0,3 atm.
Nessa transformação, sua temperatura é elevada de 300 para 600 K e seu volume sofre uma elevação de 300 litros.
Assinale a alternativa que apresenta os valores mais próximos para a variação da energia interna, o trabalho realizado e a quantidade de calor trocada pelo gás,respectivamente.
(Considere R = 8,3 J/mol.K e 1 atm=1 x 10⁵ Pa)
No estudo do comportamento dos gases, há uma conhecida equação de estado de um gás ideal, expressa pela relação PV = nRT, em que P é a pressão do gás, V é o volume ocupado pelo gás, n é o número de mols do gás, T é a temperatura absoluta do gás, medida em Kelvin (K); e R, com valor igual a 0,082 atm.L/(mol.K), é a constante universal dos gases.
Tendo como referência as informações acima, e sabendo que zero Kelvin corresponde a - 273,15 ºC, julgue o item a seguir.
Em uma expansão isotérmica em que não há perda de gás, a
pressão aumenta.
No estudo do comportamento dos gases, há uma conhecida equação de estado de um gás ideal, expressa pela relação PV = nRT, em que P é a pressão do gás, V é o volume ocupado pelo gás, n é o número de mols do gás, T é a temperatura absoluta do gás, medida em Kelvin (K); e R, com valor igual a 0,082 atm.L/(mol.K), é a constante universal dos gases.
Tendo como referência as informações acima, e sabendo que zero Kelvin corresponde a - 273,15 ºC, julgue o item a seguir.
A pressão de um gás ideal, confinado em um recipiente
fechado, dobrará se a temperatura passar de 100 ºC para
200 ºC.
No estudo do comportamento dos gases, há uma conhecida equação de estado de um gás ideal, expressa pela relação PV = nRT, em que P é a pressão do gás, V é o volume ocupado pelo gás, n é o número de mols do gás, T é a temperatura absoluta do gás, medida em Kelvin (K); e R, com valor igual a 0,082 atm.L/(mol.K), é a constante universal dos gases.
Tendo como referência as informações acima, e sabendo que zero Kelvin corresponde a - 273,15 ºC, julgue o item a seguir.
Em uma transformação isocórica sem perda, se a pressão e a
temperatura iniciais de um gás forem, respectivamente, de
2,0 atm e 300 K, então a pressão e a temperatura finais podem
ser de 3,0 atm e 450 K.
No estudo do comportamento dos gases, há uma conhecida equação de estado de um gás ideal, expressa pela relação PV = nRT, em que P é a pressão do gás, V é o volume ocupado pelo gás, n é o número de mols do gás, T é a temperatura absoluta do gás, medida em Kelvin (K); e R, com valor igual a 0,082 atm.L/(mol.K), é a constante universal dos gases.
Tendo como referência as informações acima, e sabendo que zero Kelvin corresponde a - 273,15 ºC, julgue o item a seguir.
Se 2 mols de um gás rarefeito, que se comporta como um gás
ideal, ocupa um espaço de 30 litros e está sob uma pressão de
2,0 atm, então a sua temperatura é superior a 100 ºC.
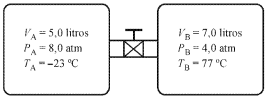
A figura acima mostra, de forma esquemática, dois recipientes contendo dois gases ideais, conectados por meio de uma válvula, que está fechada inicialmente. Com base nessas informações e nos dados apresentados na figura, julgue o item subsequente.
Quando dois sistemas gasosos quaisquer em equilíbrio térmico entre si são colocados em contato térmico, tem maior temperatura aquele cuja pressão aumenta à volume constante.
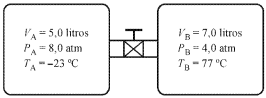
Se a válvula for aberta e a pressão for mantida 10 atm, a temperatura TA permanecerá constante em tomo de 300 K e a temperatura TB abaixará para 237 K.