Questões de Concurso
Comentadas sobre cinética química em química
Foram encontradas 652 questões
I. A energia de ativação de uma reação química pode ser reduzida pelo aumento da temperatura do sistema.
II. Reações que ocorrem em uma única etapa (elementares) apresentam velocidades independentes da concentração dos reagentes.
III. A velocidade de uma reação química pode ser influenciada por diversos fatores, tais como: temperatura, uso de catalisador e concentração de reagentes.
Quais estão corretas?
I - C12H22O11 II - MgSO4 III - NaCl IV - Ca3(PO4)2
Quais afirmativas apresentam a maior e a menor temperatura de ebulição, respectivamente?
Ao transferir-se 8,3 mL de HCl P.A. para um balão volumétrico de 500mL, qual a concentração final da solução após diluição com água destilada?
2NaN3(s) → 2 Na(s)+ 3N2(g) 10 Na(s) + 2 KNO3(s) → K2O(s) + 5 Na2O(s) + N2(g)
Dados:
Na (23 g.mol-1 ), N (14 g.mol-1 ), K (39 g.mol-1 ) e O (16 g.mol-1 ) Volume molar nas condições normais de temperatura e pressão (CNTP)=22,4L
Quando 100g de azida de sódio e 0,8 mol de nitrato de potássio são misturados, o volume de gás produzido na CNTP, em litros, para inflar o “airbag” será
Considerando esta informação e os conceitos de cinética química, analise as seguintes proposições:
I - A ordem global da reação é 3.
II - Se a concentração de B for dobrada, mantendo-se [A] constante, a velocidade da reação aumentará por um fator de 4.
III - O tempo de meia-vida desta reação independe das concentrações iniciais dos reagentes.
É CORRETO concluir o que se afirma em:
2 N2O5(g) → 4 NO2(g) + O2(g)
A lei de velocidade experimental para esta reação é: velocidade = k[N2O5]
Com base nessas informações e no conhecimento sobre cinética química, analise as seguintes proposições:
I - A reação é de primeira ordem em relação ao N2O5.
II - A velocidade da reação aumentará se a concentração inicial de N2O5 for dobrada.
III - A constante de velocidade k independe da temperatura.
É CORRETO concluir o que se afirma em:
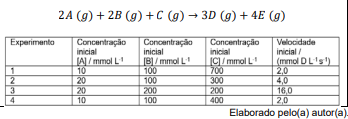
2NO(g) + O2(g) → 2NO2(g)
Em uma série de experimentos, foram obtidos os seguintes dados para a velocidade inicial da reação em diferentes concentrações dos reagentes:

Assinale a opção que representa a expressão da lei da velocidade e a ordem global da reação com base nos dados experimentais fornecidos.

Quantos gramas de água são produzidos na oxidação de 6 g de colesterol?
( ) Quando o núcleo de urânio-238 perde uma partícula alfa, o fragmento restante tem número atômico 90 e número de massa 234.
( ) Para transformar urânio-238 em rádio-226 foram emitidas 3 partículas beta (β).
( ) A radiação gama consiste em fótons de alta energia; muda a massa e o número atômico de um núcleo.
( ) Quando o rádio-226 sofre decaimento alfa o produto formado é 86Rn222.
A sequência está correta em
I. O fluxo difusional é proporcional ao negativo do gradiente de concentração, de acordo com a primeira lei de Fick.
II. O equacionamento matemático em uma única direção (x) (e quando o coeficiente de difusão é independente da concentração) é descrito pela segunda lei de Fick.
III. O perfil de concentrações é representado como um gráfico da concentração em função da distância no interior do material sólido.
IV. A condição de difusão para a qual o fluxo é independente do tempo é conhecida como regime estacionário.
V. A força motriz é o gradiente de concentração (dC/dx).
I. A velocidade de uma reação depende da concentração, mas a constante de velocidade não depende dela.
II. Quanto mais baixa for a energia de ativação, mais lenta a reação.
III. Se a velocidade de aparecimento de O2(g), 2 O3(g) → 3 O2(g), é 9 x 10–4 mol/L em determinado instante, a velocidade de desaparecimento do O3(g) é 18 x 10–4 mol/L.
Está correto o que se afirma em
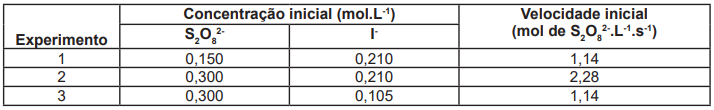
A equação química abaixo representa a síntese do íon triiodeto.
S2 O82- (aq) + 3 I- (aq) → 2 SO42- (aq) + I3 - (aq)
A fim de descobrir a ordem da reação, três experimentos foram realizados, e os resultados encontrados estão na tabela a seguir. Analise os dados da tabela e assinale a alternativa que possui a ordem desta reação.
Considere uma reação química genérica representada por aA+bB→cC+dD, onde A e B são reagentes, e C e D são produtos. Se a velocidade de uma reação é diretamente proporcional à concentração de A elevada ao quadrado (A²) e à concentração de B, qual é a ordem de reação em relação a A e B?
Considere uma reação química representada por 2A+B → 3C+D, onde A e B são os reagentes, e C e D são os produtos. Qual a equação que define a velocidade dessa reação?
Um laboratório está estudando a cinética de uma reação química e coletou dados experimentais para determinar a relação entre a concentração de um reagente “A” e a taxa de formação do produto. Após análise, foi encontrada uma regressão linear simples para os dados coletados, com equação y=0,02x+0,5, onde “y” representa a taxa de formação do produto (mol/L/min) e “x” representa a concentração do reagente “A” (mol/L).
Assinale a alternativa CORRETA, a qual apresenta a taxa de formação do produto esperada, quando a concentração do reagente “A” é de 25 mol/L.