Questões de Concurso
Comentadas sobre cinética química em química
Foram encontradas 652 questões
Julgue o próximo item, acerca da caracterização de nanomateriais.
O potencial zeta está relacionado à carga no interior da
nanopartícula.
No que se refere à modificação de superfícies, julgue o seguinte item.
A funcionalização de superfícies antimicrobianas é uma
tecnologia que pode ser utilizada para desinfecção em vários
ramos da atividade humana, por exemplo, na esterilização de
dispositivos médicos para prevenir infecções hospitalares.
Julgue o item que se segue, acerca de modificações de superfícies de biomateriais com proteínas.
Todos os métodos de modificação de superfícies de
biomateriais são essencialmente métodos químicos.
Uma solução de ácido clorídrico foi utilizada para a neutralização de 50g de soda cáustica (NaOH) com pureza de 90%. Para tal reação de neutralização foi consumido exatamente 500 ml de solução. Assinale a alternativa que contém a concentração de HCl da solução utilizada na neutralização:
“A meia-vida, t1/2, de uma substância é o tempo necessário para que sua concentração caia à metade do valor inicial”. A figura abaixo mostra a concentração do cloreto de butila (C4H9Cl) como uma função do tempo:
(ATKINS; JONES, Princípios de Química: questionando a vida moderna e o meio ambiente, Editora Bookman, 2006)
Variação da Concentração com o Tempo
Fonte: BROWN; LEMAY; BURSTEN, Química: a ciência central, São Paulo: Pearson Prentice Hall, 2005, p. 487
Pode-se concluir, observando o gráfico, que a meia-vida da reação de C4H9Cl com água ocorre aproximadamente no tempo de:
A teoria de Arrhenius para ácidos e bases é baseada da dissociação eletrolítica dos íons hidrogênio e hidroxila em meio aquoso. No entendimento de Arrhenius, as bases são compostos que, quando dissolvidos em água, aumentam a concentração de íons OH-. Essa teoria/definição explica apenas alguns fenômenos básicos (quando dissolvidos em água), porém não explica quando envolvidas substâncias em soluções não aquosas. De acordo com a teoria mais abrangente existente, as bases são compostos que doam um par de elétrons. Qual/is foi/foram o(s) cientista(s) proponente(s) de tal definição?
(BROWN, Theodore L. Química, a ciência central. São Paulo: Prentice Hall, 2005)
Observe as seguintes afirmações sobre as condições para a ocorrência de reações químicas:
I - É necessário haver afinidade química entre os reagentes.
II - As colisões precisam ser favoráveis entre suas moléculas.
III - É necessário que a barreira energética dos reagentes seja superada por meio da Energia de ativação.
IV - Menor superfície de contato entre reagentes facilita as colisões.
Qual a alternativa CORRETA?
Acerca dos conceitos de cinética química, julgue o item.
Uma reação de ordem zero pode ser expressa como “velocidade = constante de velocidade”.
A lei de velocidade de uma reação é determinada experimentalmente e não pode, em geral, ser obtida a partir da equação química da reação.
Com referência aos conceitos de equilíbrio químico, julgue o item.
O catalisador não altera a composição do equilíbrio químico.
Dada a reação hipotética:

A partir de dados experimentais, verifica-se que o composto A é um reagente de terceira ordem e a substância B é um reagente de primeira ordem da reação.
Se duplicarmos as concentrações dos reagentes A e B, a
velocidade dessa reação aumentará:
Sobre essa lei conclui-se que, para uma reação em meio gasoso, a constante de velocidade
A relação entre essas grandezas é expressa por
Em um experimento, realizou-se um estudo cinético da seguinte reação química:
2 N2 O5 (g) → 4 NO2 (g) + O2 (g)
Esse estudo indicou que essa é uma reação química de
primeira ordem e que a constante de velocidade é igual
a 3,4 x 10-4 s-1 a 25ºC.
Para uma concentração de N2
O5
igual a 0,2 mol L-1
, a
velocidade da reação, em mol L-1
s-1
, corresponde a
Em uma síntese industrial, o HBr é produzido a partir da seguinte reação química:
H2 (g) + Br2 (g) → 2 HBr (g)
No início da síntese, a concentração de H2
era de 0,3 mol/L.
Após 20 minutos, sua concentração passou a 0,1 mol/L.
Nesse intervalo de tempo, a velocidade média de formação de HBr, em mol L-1
min-1
, correspondeu a
No gráfico abaixo estão representados os caminhos de uma reação com catalisador e uma sem catalisador.
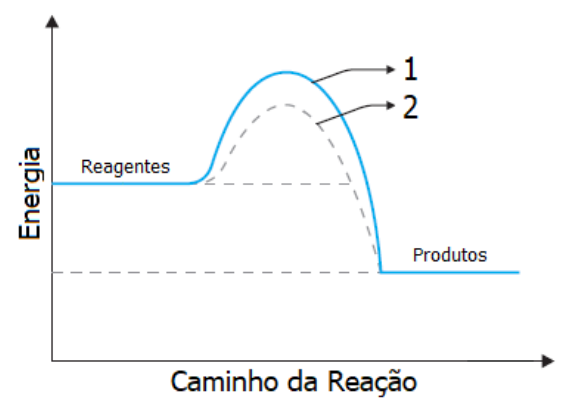
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) com base nesse gráfico.
( ) A curva 1 refere-se à reação não catalisada e a curva 2 refere-se à reação catalisada.
( ) A energia de ativação da curva 1 é maior do que a da curva 2.
( ) A utilização de um catalisador na reação aumenta o valor de ∆H.
( ) O complexo ativado da curva 1 apresenta a mesma energia do complexo ativado da curva 2.
( ) Se a reação seguir o caminho da curva 2, ela será mais rápida.
Assinale a alternativa que indica a sequência correta,
de cima para baixo.
CuS + HNO3 ➔ Cu(NO3)2 + S + NO + H2O
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) em relação à reação dada.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
( ) A soma total de íons entre os produtos deve ser igual à soma total de íons entre os reagentes.
( ) O agente oxidante é o HNO3 e o agente redutor é o CuS.
( ) O total de elétrons cedidos pelo agente redutor deve ser igual ao total de elétrons recebidos pelo agente oxidante.
( ) Os coeficientes 3, 8, 3, 3, 2, 4 tornarão a equação balanceada.