Questões de Concurso
Comentadas sobre cinética química em química
Foram encontradas 652 questões
N2Os(g) → 2NO2(g) + 1/2 O2 (g)
Dados: ln 0,04062 = 3,204; ln 0,03421 = - 3,375 R = 62,36 L torr/mol K
“A maior ameaça à camada de ozônio no século XXI é o gás hilariante (N2O - óxido nitroso). Segundo o Pnuma (Programa das Nações Unidas para o Meio Ambiente), análises de cientistas de 35 organizações revelaram que o N2O, agora, é o gás mais importante a exaurir o ozônio e o terceiro mais poderoso gás do aquecimento global emitido na atmosfera. Os níveis de N2O aumentaram nas últimas décadas, puxados sobretudo pelos processos de nitrificação e de desnitrificação dos fertilizantes nitrogenados no solo.”
Disponível em: <https://www.terra.com.br/noticias/ciencia/clima/onu-faz-soaroxido-nitroso-a-camada-de-VgnCLD2000000dc6eb0aRCRD.html>. Acesso em: 24 nov. 2020.
O mecanismo de destruição pode ser resumido pelas seguintes equações:
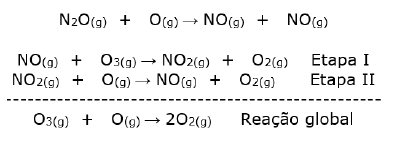
A classificação química do óxido nitroso e a função do NO no mecanismo de destruição do ozônio são, respectivamente:
2 H2O2 (aq) → 2 H2O (l) + O2 (g)
Em um estudo cinético dessa reação, mediu-se a velocidade da reação em dois experimentos nos quais se variou a concentração inicial de H2O2, conforme apresentado a seguir:
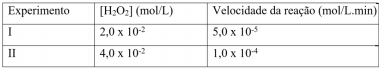
A constante de velocidade dessa reação, em min-1 , é igual a:
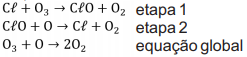
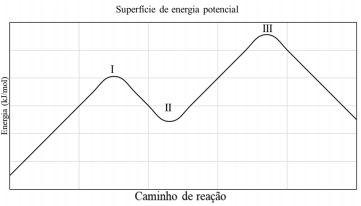
Ao comparar o mecanismo com a SEP, pode-se concluir que a espécie II indicada no diagrama é o:
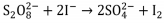
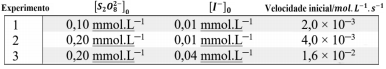
De acordo com a reação química balanceada e os dados experimentais de velocidade, a lei de velocidade experimental é:
Fe2O3 (s) + x H+ (aq) ⇌ y Fe3+ (aq) + z H2O (l)
Com base nessas informações, julgue o seguinte item.
Na reação do Fe2O3 apresentada, o ácido é o catalisador.
O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.

O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.

I O aumento da pressão aumentou a velocidade da reação até atingir o limite desse parâmetro, pois, com o aumento da pressão de H2, mais hidrogênio foi dissolvido na solução.
II O aumento da pressão aumentou a velocidade da reação, o que comprova que a reação é de 1.ª ordem em relação ao hidrogênio.
III O fato de haver um limite para o aumento da velocidade da reação devido à pressão indica que existe uma capacidade limitada do catalisador de suportar o H2.
Assinale a opção correta.
O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.

NO (g) + O3 (g) ⇌ NO2 (g) + O2 (g)
Estudos mostraram que, quando esses dois gases são colocados em um mesmo recipiente a 25 °C e 1 atm, cada molécula colide, em média, cerca de um bilhão de vezes por segundo com outras moléculas. Se todas essas colisões resultassem em formação de produto, a reação aconteceria em uma fração de segundo. Porém, não é isso que se observa empiricamente, sendo a reação muitíssimo mais lenta.
Nesse caso, para que a reação aconteça, a simples colisão entre as moléculas não é suficiente; é necessário, também, que
Com base nessas informações, é correto afirmar que, se as concentrações iniciais de quinina e de ácido forem, respectivamente, de 0,250 mol/L e 0,160 mol/L, então a velocidade inicial da reação será igual a
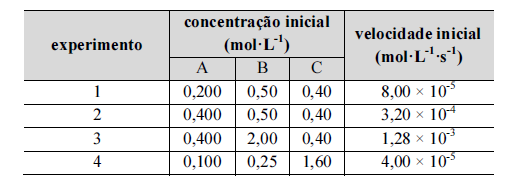
Com relação à situação hipotética precedente, assumindo-se v como a velocidade da reação e k como a constante de velocidade, é correto afirmar que a lei de velocidade dessa reação é dada por
A exposição à radiação ultravioleta pode causar queimadura na pele, lesão em células epiteliais, alteração do DNA, inflamação, dilatação dos vasos sanguíneos, câncer, entre outros fatores adversos. O ozônio (O3) existente na estratosfera atua como um filtro dos raios ultravioletas provenientes do Sol.
Uma das evidências de que os átomos são formados por partículas menores se veio através de experimentação. Sabemos hoje, que o átomo é formado por elétrons, prótons, e outras partículas subatômicas. Sobre a descoberta do elétron, responda a alternativa correta.
Tendo em vista os fatores que influenciam a velocidade de uma reação química, assinale a alternativa INCORRETA:
Três elementos químicos são representados pelas letras W, X e Z. A tabela abaixo mostra as energias de ionização de cada um deles.
Elemento |
Energia de Ionização (kJ/mol) |
||
1º |
2º |
3º |
|
W |
738 |
1451 |
7733 |
X |
900 |
1757 |
14848 |
Z |
520 |
7298 |
11815 |
A partir das informações descritas na tabela, responda a alternativa correta.
Uma professora de Química precisou repor o estoque de ácido nítrico do laboratório da escola. Para isso, ela fez uma planilha com 3 soluções aquosas de 3 fornecedores diferentes.
Fornecedor |
Massa total da solução (gramas) |
Concentração em % de ácido nítrico massa/massa |
Preço em Reais (R$) |
I |
1000 |
53 |
50 |
II |
1500 |
50 |
75 |
III |
5000 |
53 |
265 |
Com base nos dados da tabela, qual(is) dos fornecedores tem o menor preço por quantidade de ácido nítrico?
A falta de gás oxigênio em reações de combustão pode levar a uma reação incompleta. Veja os exemplos de reações de combustão completa e incompleta do carvão:
- Combustão completa:
- Combustão incompleta:
Responda a alternativa correta.