Questões de Concurso
Comentadas sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 305 questões
I. A forma de corrosão denominada uniforme se processa em toda a extensão da superfície, ocorrendo perda uniforme da espessura. II. Todos os metais estão sujeitos ao ataque corrosivo se o meio for sufcientemente agressivo. III. Os metais ouro e prata não sofrem nenhum tipo de corrosão. Está correto o que se afirma em:
Qual o potencial da célula, em V, para o processo eletroquímico no qual o ferro pode reduzir os íons prata?

O texto a seguir foi adaptado de Quim. Nova, v. 39, 732- 740, 2016.
“Nos ambientes aquáticos, a concentração de fosfatos na coluna de água é dependente de alguns fatores, como o par redox Fe(II)/Fe(III), uma vez que nas camadas superficiais sua associação com os oxi-hidróxidos de Fe(III) formam compostos que apresentam baixa solubilidade e migram para camadas mais profundas (sedimento). Nessas camadas os oxi-hidróxidos de Fe(II), mais solúveis que os compostos de Fe(III, são formados, com a liberação do fosfato, estabelecendo um ciclo onde o fósforo migra novamente para as camadas superficiais.”
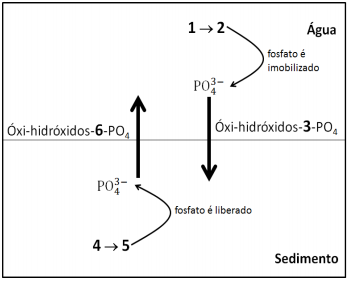
O equilíbrio químico descrito no texto evidencia que os
números 1, 2, 3, 4, 5 e 6 são:
Com base nos conceitos de eletroquímica e de radioquímica, julgue o próximo item.
Agente oxidante é uma espécie que fornece elétrons a
uma substância que está sendo reduzida (e ela própria
sendo oxidada) em uma reação de oxirredução. Agente
redutor é a espécie que remove elétrons da espécie que
está sendo oxidada (e ele próprio é reduzido) em uma
reação de oxirredução.
Com base nos conceitos de eletroquímica e de radioquímica, julgue o próximo item.
Eletroquímica é o ramo da química que trata do uso de
reações químicas para produzir eletricidade, das forças
relativas dos agentes oxidantes e redutores e do uso da
eletricidade para produzir mudança química.
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue o item que se segue.
O estado de equilíbrio da reação de uma pilha recarregável
é deslocado pela passagem de corrente elétrica.
“O cromo pode ser liberado para o ambiente por meio de resíduos originados de um amplo número de processamentos industriais, incluindo a indústria curtumeira, têxtil e de metalurgia do ferro, aço e outros metais. Dentre as formas normalmente encontradas na natureza, o cromo hexavalente apresenta-se como cromatos e dicromatos (CrO42- e Cr2O72- ), os quais são tóxicos e mutagênicos, solúveis em uma ampla faixa de pH e geralmente móveis no sistema solo/água. O cromo trivalente apresenta-se na forma do cátion Cr3+ e do ânion CrO2- , sendo consideravelmente menos tóxico e de baixa mobilidade, em razão de sua precipitação como óxidos e hidróxidos em pH superior a 5,0.”
Um dos processos de transformação do cromo hexavalente tóxico em cromo trivalente menos tóxico, é a reação destes compostos com ferro puro ou cátion Fe2+ como mostram as reações abaixo (a 25 ºC e 1 atm).
Fe(s) + CrO42−(aq) + 4H2O(l)  Fe(OH)3(s) + Cr(OH)3(s) + 2OH−(aq)
Fe(OH)3(s) + Cr(OH)3(s) + 2OH−(aq)
6Fe2+(aq) + Cr2O72−(aq) + 14H+  6Fe3+(aq) + 2Cr3+(aq) + 7H2O(l)
6Fe3+(aq) + 2Cr3+(aq) + 7H2O(l)
Dados: potenciais de redução em volts (V) a 25 ºC e 1 atm
Fe2+(aq)  Fe3+(aq) + e− E0 = −0,77
Fe3+(aq) + e− E0 = −0,77
Fe0(s)  Fe3+(aq) + 3e− E0 = 0,04
Fe3+(aq) + 3e− E0 = 0,04
CrO42−(aq) + 4H2O(l) + 3e−  Cr(OH)3(s) + 2OH−(aq) E0 = −0,12
Cr(OH)3(s) + 2OH−(aq) E0 = −0,12
Cr2O72−(aq) + 14H+ (aq) + 6e−  2Cr3+(aq) + 7H2O(l) E0 = 1,33
2Cr3+(aq) + 7H2O(l) E0 = 1,33
Ao fazer a ligação do anodo com a estrutura, estando ambos em contato simultâneo com o eletrólito, forma‐se uma pilha na qual a corrente que circula resulta da dissociação eletroquímica do anodo. A utilização de anodos de sacrifício em tubulações pode ser analisada a seguir.
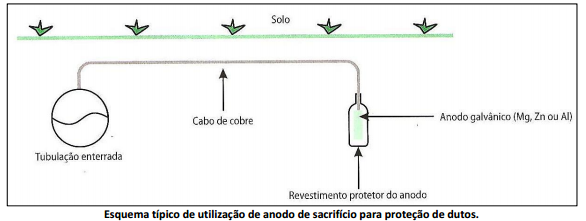
De acordo com a figura anterior, marque V para as afirmativas verdadeiras e F para as falsas.
( ) Os produtos de corrosão são Mg(OH)2, Al(OH)3, Zn(OH)2.
( ) Reação da área catódica aerada: 2 H2O + 2e– → H2+ 2OH– .
( ) A proteção catódica é um método de controle de corrosão que consiste em transformar a estrutura a proteger no catodo de uma célula eletroquímica ou eletrolítica, uma vez que é o anodo quem sofre a oxidação.
A sequência está correta em
Está(ão) correta(s) apenas a(s) afirmativa(s)
I. O processo é espontâneo. II. Têm‐se as reações nas áreas: anódica: Zn → Zn2+ + 2e. Catódica: H2O + ½ O2 + 2 e → 2OH– . III.Houve corrosão do ferro formando o resíduo Fe3 [Fe(CN)6]2.
Está(ão) correta(s) apenas a(s) afirmativa(s)
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
Os mesmos produtos produzidos na eletrólise do NaCl puro são obtidos na eletrólise de uma solução aquosa de NaCl.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
Na produção do sódio metálico, é possível realizar a eletrólise do NaCl na forma sólida.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
A partir da localização do N a e do K na tabela periódica, é correto concluir que a eletrólise do KC1 requer a aplicação de um potencial elétrico maior que aquele requerido para a eletrólise do NaCl.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
A formação de 2,0 g de sódio metálico deve ser acompanhada pela formação de uma massa superior a 4,0 g de Cl2.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
No processo, sabendo que M(Na) = 23 g/mol, a circulação de uma corrente elétrica igual a 2,0 A em um intervalo de 4.825 s deve produzir uma massa superior a 2,0 g de sódio metálico.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximos item.
O potencial elétrico mínimo (E) que deve ser aplicado à célula eletrolítica para que ocorra a eletrólise do NaCl pode ser calculado pela equação E = E (Na+/Na) + 2E (Cl2/ Cl- ) , em que E ( Na+ /Na ) e E(C12 /Cl- ) são, respectivamente, os potenciais elétricos de redução dos pares Na+/Na e Cl2/Cl- na temperatura do experimento.