Questões de Concurso
Comentadas sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 305 questões
Os dados da tabela acima se referem a testes realizados, a 298 K, utilizando-se o método das velocidades iniciais, para determinação da lei de velocidade para a reação do BO3-(aq) com o Br-(aq) em meio ácido. A equação não balanceada para essa reação é a seguinte.
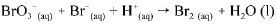
A respeito da reação acima e dos com postos nela envolvidos, e considerando as informações fornecidas, julgue o item que se segue.
A reação em questão pode ser considerada uma reação de oxi-redução.
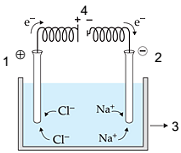
Fonte: adaptado de <www.ohomempodetantoquantosabe.blogspot.com.br>.
Acesso em 20 jul. 2015.
Os componentes 1, 2, 3 e 4 desse sistema são, respectivamente:
2KNO3(s) + S(s) + 3C(s) -> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
A redução do nitrato, que consome três moles de elétrons por mol de NO3 – em meio ácido, gera o óxido nítrico, que é um agente complexante mais forte que o íon nitrato
KNO2(aq) + KI(aq) + H2SO4(aq) → NO(g) + K2SO4(aq) + H2O(ℓ) + 1/2 I2(aq)
Analise as afirmativas abaixo e marque a alternativa CORRETA.
Dados:
Zn 2+(aq) + 2è → Zn(s) E0 = - 0,76V
2H+(aq) + 2è → H 2(g)E0 = 0,00V
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.
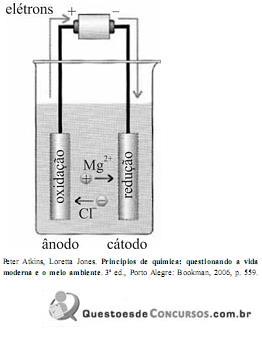
Com base nas informações e na figura acima, julgue o item.
A galvanização é um método utilizado para prevenir a corrosão de metais, em que um primeiro metal é encoberto por um segundo metal, devendo este segundo, para isso, estar abaixo do primeiro na série eletroquímica, uma vez que, ao sofrer deterioração, o segundo libera seus elétrons para o primeiro. Dessa forma, é correto afirmar que a galvanização é um processo eletroquímico.
Na proteção com metal de sacrifício, o material a ser protegido é conectado como ânodo de uma célula galvânica, sendo o cátodo um metal mais ativo que se consome à medida que protege o material.
Há casos benéficos de corrosão, como a oxidação de aços inoxidáveis, que produz uma camada protetora de óxido de cromo, e a proteção do material de alumínio, com a formação de óxido de alumínio.
O potencial medido em volts, numa certa temperatura T e em relação ao eletrodo padrão de hidrogênio (EPH), é
Dados Da equação de Nernst: RT/F = 0,06 V
Fe 3+ + e → Fe 2+ E0 = +0,77 V
E0EPH = 0V
SnCl2(aq) + 2 FeCl3(aq) → SnCl4(aq)+ 2 FeCl2(aq)
Qual a concentração, em quantidade de matéria (mol/L), da espécie Sn 4+ formada?
Mg+2 + 2e ⇆ Mg E0Red = - 2,34 V
Al+3 + 3e ⇆ AlE0Red = - 1,67 V
Pb+2 + 2e ⇆ Pb E0Red = - 0,13 V
Bi +3 + 3e ⇆ Bi E0Red = + 0,21 V
Ag+1 + 1e ⇆ Ag E0Red = + 0,80 V
Qual a opção que corresponde a uma reação espontânea?
A soma dos coeficientes da equação acima, acertados pelo método redox, corresponde a
Considerando que a quantidade de eletricidade (carga) de 1 mol de elétrons é igual a 96.500 C, qual o tempo, em s, necessário para se obter 9,2 g de sódio, por esse processo, utilizando uma corrente constante e igual a 10 A?
Qual a maior voltagem que se pode extrair desse artefato quando os materiais disponíveis são Zn, Fe e Ag?
Dados:
Zn2+ + 2e → Zn (Ered0 = -0,76 V)
Fe2+ + 2e → Fe (Ered0 = -0,44 V)
Ag+ + 1e → Ag (Ered0 = 0,80 V)
Durante o uso (descarga) dessa bateria, como acontece quando se dá partida no automóvel, o
PbO 2(s) + Pb (s) + 2 H 2 SO 4(aq) → 2 Pb SO 4(s)+ 2 H 2 O (l)
Na bateria, o polo negativo ou anodo da pilha é
8 HI + H2 SO4 → H2 S + 4 H2 O + 4 I 2
Os elementos que sofrem oxidação e redução, respectivamente, são
HNO3 + I 2 → HIO3 + NO + H2 O
Sabendo-se que essa reação química é de oxirredução, afirma-se que os agentes oxidante e redutor são, respectivamente,
