Questões de Concurso
Comentadas sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 157 questões
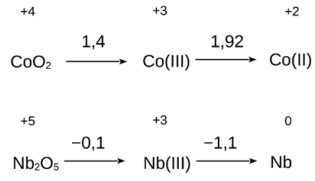
Admitindo-se que essas espécies possam estar participando do processo responsável pelo acendimento do LED, que opera entre 1,5 e 2,7 V, a possível pilha formada envolve:
Ventura, D. O lendário azul da Prússia, cor que pode salvar ou tirar vidas. Disponível em www.bbc.com. Adaptado.
A distribuição eletrônica na valência do par associado à conversão eletroquímica de oxidação mencionada no texto é descrita por:
A respeito de estequiometria, processo de fabricação, corrosão e soldagem, julgue o item a seguir.
Em uma soldagem com eletrodo revestido, o elevado ponto
de fusão do tungstênio permite a aplicação desse metal como
eletrodo não consumível.
A respeito de estequiometria, processo de fabricação, corrosão e soldagem, julgue o item a seguir.
O tipo de corrosão mais comum nas tubulações e
equipamentos industriais é a eletroquímica, na qual um
componente oxida, ou seja, ganha elétrons, e o outro reduz,
ou seja, perde elétrons.
No que se refere a reações de óxido-redução, julgue o próximo item.
Nas reações de óxido-redução, os elétrons perdidos pela
espécie que sofre redução serão recebidos pela espécie que
se oxida.
Um valor de força eletromotriz positiva está associado a um processo redox espontâneo.
Se uma barra de cobre for colocada dentro de uma solução de H2SO4 em condições padrão, então, considerando-se os potenciais padrão de redução do cobre (Cu2+/Cu, 0,337 V) e do hidrogênio (H+/H2, 0,000 V), a barra de cobre reagirá, e a solução se tornará azul pela presença de Cu2+.
A força eletromotriz é associada à espontaneidade da reação por meio da entalpia.
Em função do potencial de redução de cada semirreação, a força eletromotriz é calculada subtraindo-se o potencial de redução da semirreação de oxidação do potencial de redução da semirreação de redução.
Considere as informações apresentadas no quadro a seguir para responder à questão abaixo :

( ) Na oxidação do ferro exposto ao tempo, no anodo ocorre a reação Fe → Fe2+ + 2e − e no catodo ocorre a reação O2 +4H + + 4e − → 2H2O.
( ) Uma forma de proteger a oxidação do ferro e fazer uma proteção catódica, é usar um metal de sacrifício como o magnésio. Isso ocorre pois o ferro possui um potencial de redução mais negativo que o magnésio.
( ) A proteção de superfícies metálicas da corrosão independe do meios corrosivos existentes, sendo o meio corrosivo, um fator secundário da corrosão.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
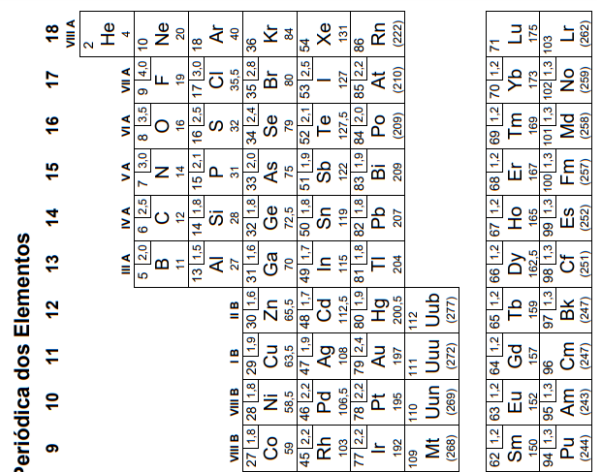
O quadro abaixo apresenta potenciais-padrão (E0) para semirreações de redução de cinco elementos.
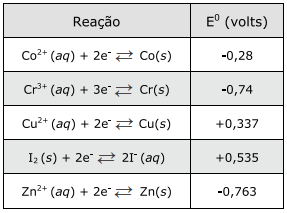
A ordem crescente de poder redutor conforme as
reações de redução acima é
Em um laboratório didático, para ensinar a tabela de potencial-padrão de redução (E0), foi construída uma pilha usando limão como eletrólito, conforme a figura.

Fonte: www.preparaenem.com/quimica/pilha-limao.htm
O laboratório dispunha dos metais apresentados no quadro a seguir.

Foi escolhido um fio de zinco como ânodo. Para que
a cela seja espontânea, como cátodo pode(m) ser
escolhido(s)
A reação que ocorre entre o permanganato de potássio e os íons Fe2+, em meio ácido, é representada pela equação não balanceada
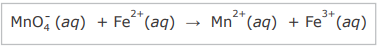
Em relação à reação, considere as afirmativas.
I - São necessários 4 íons H+ nos reagentes para balancear essa equação.
II - O íon Fe2+ é o agente redutor nessa reação.
III - O número de oxidação do íon manganês varia de +4 no reagente para +2 no produto.
Está(ão) correta(s)
[Dados. Potenciais de redução padrão:
E0Al3+|Al = -1,66 V; E0Cu2+|Cu = +0,34 V.]
Nessas condições, analise as afirmativas a seguir a respeito desse sistema eletroquímico:
I. Será uma pilha, pois a reação esperada é espontânea. II. A diferença de potencial esperada é 7,32V. III. Será uma reação espontânea se um potencial externo de 2,00V for aplicado ao sistema.
Está correto o que se afirma em
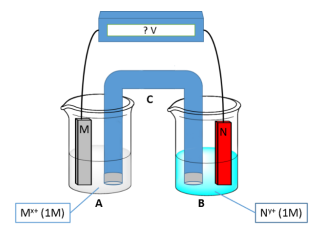
Com base nestas informação assinale a alternativa correta.
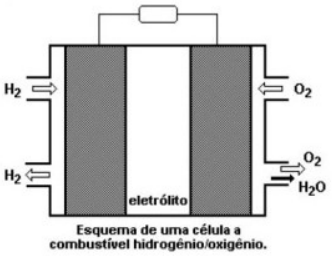
Sobre a pilha de hidrogênio, pode-se afirmar que
Corrente Elétrica 10 A
Tempo 30 min
Pressão 1,0 atm
Temperatura 273 K
Sabendo que, nessas condições, foram recolhidos 1,7 L de gás hidrogênio é possível prever que o rendimento do processo foi, aproximadamente, de
(Dado: Constante de Faraday = 96.500 s.A.mol-1)
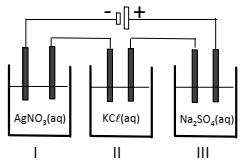
Cada cuba era constituída por um par de eletrodos inertes, continham soluções aquosas de AgNO3, KCl e Na2SO4 de mesma concentração e operaram durante um mesmo período de tempo em iguais condições.
A partir dessas informações, assinale V para a afirmativa verdadeira e F para a falsa.
( ) Na cuba I observa-se formação de gás no cátodo.
( ) Na cuba II o pH da solução aumenta ao longo do processo. ( ) Na cuba III um depósito sólido é formado no ânodo.
As afirmativas são, respectivamente,