Questões de Concurso
Comentadas sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 534 questões
São características do sistema galvânico e do sistema corrente impressa, respectivamente:
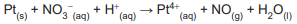
A soma dos coeficientes estequiométricos de reagentes e produtos na reação balanceada é
Dados: MMCu = 63,5 g mol-1 / Constante de Faraday = 96500 C
Nessas condições, o valor da energia livre de Gibbs padrão da reação, em kJ mol-1, é mais próximo de
Dado
Constante de Faraday (F) = 96500 C mol-1
NO-3 + 8 Cℓ- + 10H+ → 4 Cℓ2 + NH+4 + 3 H2O
Nessa reação, a espécie química que sofre oxidação é
Acerca do equilíbrio em células galvânicas, julgue o próximo item.
Considera-se que o potencial produzido por uma célula
galvânica seja a soma das contribuições do anodo e do
catodo, ainda que o potencial de junção líquida seja
considerável.
Acerca do equilíbrio em células galvânicas, julgue o próximo item.
O potencial arbitrariamente atribuído ao eletrodo-padrão de
hidrogênio, na faixa de temperatura de 20 ℃ até 30 ℃, é
0 V.
As armas de fogo são artefatos de dimensões e formas diversas que arremessam um ou mais projéteis utilizando a força de expansão de gases resultantes da combustão da pólvora. Atualmente se utilizam pólvoras baseadas em nitrocelulose e nitroglicerina, mas antigamente as armas de fogo usavam a pólvora preta, cuja combustão é representada pela equação a seguir, que está desbalanceada:
S(sol.) + C(sol.) + KNO3 (sol.) → CO2 (g) + N2 (g) + K2S (sol)
A equação equilibrada estequiometricamente é
Considere as equações químicas a seguir.
I NH3 + H2O ⇌ NH4+ + OH−
II Cu2+ + 4 NH3 ⇌ [Cu(NH3)4] 2+
III 2 Fe3+ + Sn2+ ⇌ 2 Fe2+ + Sn4+
Ocorre reação de oxirredução apenas na(s) equação(ões)
No que se refere aos processos de corrosão, julgue o item a seguir.
Zinco e magnésio são frequentemente utilizados como
anodos de sacrifício em métodos de proteção galvânica em
ferro, por possuírem maior potencial eletroquímico.
No que se refere aos processos de corrosão, julgue o item a seguir.
A corrosão galvânica consiste na remoção de elétrons do
catodo na presença de um material com potencial de eletrodo
maior.
A corrosão de metais pode ser definida como o ataque eletroquímico destrutivo e não intencional que geralmente se inicia na superfície. O problema da corrosão metálica é de grande proporção no âmbito econômico, sendo estimado aproximadamente 5% das receitas de uma nação industrializada sejam gastos na prevenção deste processo e na manutenção ou substituição de produtos perdidos ou contaminados, resultado de reações corrosivas.
(Fonte: CALLISTER, W; RETHWISCH, D. Ciência e Engenharia de Materiais Uma Introdução. 8 ed, Rio de Janeiro, LTC, 2012 Com adaptado).
Em relação à corrosão galvânica, existem várias medidas que podem ser adotadas para diminuir seus efeitos. Uma dessas medidas é:
Os principais meios corrosivos de materiais são os mecanismos químico e eletroquimico. No processo de corrosão eletroquímica, ocorre um fluxo de elétrons, que se desloca de uma área da superfície metálica para a outra. A diferença de potencial de natureza eletroquimica, se estabelece entre as regiões que envolvem transferência desses elétrons. As reações na corrosão eletroquimica são anódicas e catódicas (oxidação e redução). Assim, é correto afirmar que:
I - Realizarem-se, necessariamente, na presença de água líquida.
II - Realizarem-se em temperaturas, acima do ponto de orvalho.
III - Realizarem-se devido à formação de pilhas de corrosão ou células eletroquímicas.
Está correto o que se afirma em:
Assinale a alternativa que preenche, corretamente, a lacuna do texto:
I - Reação espontânea.
II - Dividida em Ígnea e Aquosa.
III - Precisa de energia elétrica para ocorrer.
Está correto o que se afirma em:
Adaptado. Pilhas e Baterias de Lítio. Pilha e Baterias de íon lítio (uol.com.br). (Acesso em 23 de Julho de 2021).
Com relação à pilha de lítio usada em marca-passos e as transformações nela ocorridas, assinale a alternativa correta.