Questões de Concurso
Comentadas sobre equilíbrio químico em química
Foram encontradas 301 questões
Como as soluções de hidróxido de sódio e ácido clorídrico foram destinadas apenas para correção de pH e, portanto, não precisam ser padronizadas, é adequado prepará-las pesando-se os reagentes comerciais correspondentes em balança semianalítica.
Para ser utilizado na aferição do pH das soluções, o ph-metro deve ser calibrado com, pelo menos, um padrão de calibração comercial, de preferência na região de pH alvo da solução a ser aferida.
Situação hipotética: Um minério contendo magnetita (Fe3O4) foi analisado pela dissolução de uma amostra em HCl concentrado, o que resultou em uma mistura de Fe2+ e Fe3+. Depois de adicionado HNO3 para oxidar o Fe2+ a Fe3+, a solução resultante foi diluída com água e todo o Fe3+ foi precipitado como Fe(OH)3 pela adição de NH4OH. Após filtragem e enxágue, o resíduo foi calcinado, resultando em Fe2O3 puro. Assertiva: Nesse caso, a massa de Fe3O4 presente na amostra é corretamente calculada multiplicando-se por 2/3 a massa de Fe2O3 obtida ao final do processo.
Situação hipotética: Dois ácidos monopróticos, um forte e um fraco, têm a mesma concentração e o mesmo volume inicial e foram titulados com uma mesma solução de NaOH. O gráfico a seguir mostra as curvas de titulação desses dois ácidos monopróticos.
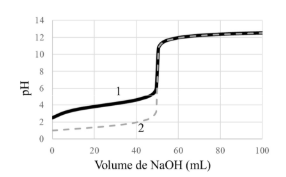
Assertiva: No gráfico, a curva 1 representa a titulação do ácido fraco.
Na titulação de um ácido monoprótico cuja constante de dissociação ácida seja Ka = 1 × 10−4, o indicador ácido-base escolhido terá o melhor rendimento se tiver pKa = 4.
Na sequência o iodo foi titulado com tiossulfato de sódio a 0,100 mol/L até o ponto final, com o gasto de 30,00 mL de titulante. Esta última reação foi: I2 + 2 S2O2-3(aq) ➝ 2 I-(aq) + S4O2-6(aq).
Diante das informações, assinale a opção que mostra A PORCENTAGEM EM MASSA DE ZINCO NA AMOSTRA de latão: Dados: massas molares (g/mol): Cu = 63,5; Zn = 65,4.
Diante das informações e a partir dos seus conhecimentos, assinale a opção que mostra aproximadamente O VALOR DO pOH de uma solução de pH 8,50, a 37 °C:
Dados: densidade da água = 1000 g/L; massa molar da água = 18 g/mol; log(1,73) = 0,24; log(3) = 0,48.
Diante dessas informações, assinale a opção que mostra O VALOR DA CONSTANTE DE EQUILÍBRIO, Kp, para a reação de dimerização e a afirmação CORRETA que expressa a influência da pressão (FAVORECE OU DESFAVORECE) na dimerização:
Diante das informações, assinale a opção que mostra o valor do pH (após o equilíbrio) de uma solução em que são adicionados 0,01 mol/L de Zn2+ e 0,02 mol/L de OH- , a 25 °C: Dados eventualmente necessários: Kw (H2O), a 25 °C = 1,00 x 10-14; (3)1/3 = 1,44; log (1,44) = 0,16; log (2,88) = 0,46; (6)1/2 = 2,45; log (2,45) = 0,39; log (4,9) = 0,69.
H0 = pKa(BH+) - log [BH+] / [B]
onde B é um indicador básico, BH+ é o ácido conjugado desse indicador e pKa(BH+) é a constante de acidez deste último. Quando o indicador é nitroanilina (C6H6N2O2), experimentos realizados para ácidos puros nas mesmas condições, permitem construir a tabela abaixo:
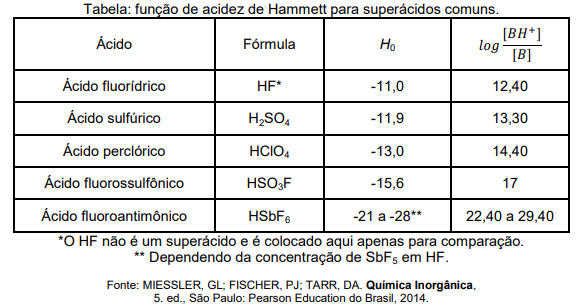
Diante dessas informações, assinale a opção que mostra a ÚNICA reação termodinamicamente espontânea entre pares das substâncias citadas acima:
FARIAS,R.F. Introdução à Química Forense. 3ª edição. Campinas, SP: Editora Átomo, 2010. p. 38-39 (adaptado).
Considere o pH 6,0 da urina um valor dentro dos padrões. A urina de um indivíduo que sofre de anorexia, após consumo de anfetamina, pode ter
Assinale a opção que indica o valor da constante de equilíbrio em função das pressões.
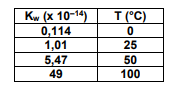
Considerando os dados apresentados, assinale a alternativa que contém a afirmativa correta.
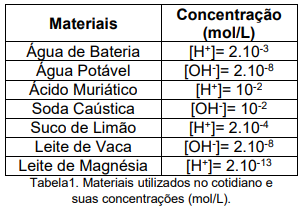
Ao observarmos os dados da tabela, assinale a alternativa correta em relação aos valores de pH dos materiais apresentados. Use: log2=0,3.