Questões de Concurso
Comentadas sobre equilíbrio químico em química
Foram encontradas 301 questões
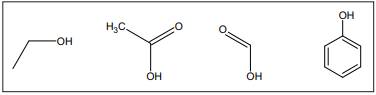
Em uma reação de esterificação, o pKa do catalisador é um fator muito importante para o melhor rendimento do produto de interesse. Dentre os compostos apresentados, a ordem crescente de pKa é:
Fe2O3 (s) + x H+ (aq) ⇌ y Fe3+ (aq) + z H2O (l)
Com base nessas informações, julgue o seguinte item.
A constante de equilíbrio K da reação do óxido de ferro (III) é corretamente expressa pela seguinte equação. K = [ Fe3+ ]y [ H20]z / [Fe2O3] [ H+]x
3 Cuo(s) + 8 HNO3(aq) → 3 Cu(NO3)2(aq) + 2 NO(g) + 4 H2O(l) (1) 2 NO(g) + O2(g) → 2 NO2(g) (2) NO2(g) ⇌ N2O4(g) (3)
Isso posto, considerando um sistema transparente e fechado, o produto NO2(g) apresenta coloração marrom. O produto N2O4(g) é um gás incolor e, quando o sistema é aquecido acima da temperatura ambiente, o sistema apresenta uma coloração marrom (forte). Em relação à equação três, referente à formação do N2O4(g), é correto afirmar que:
I- Os valores de ka e pKa não podem ser utilizados de forma quantitativa, somente qualitativa. II- De maneira genérica, a constante de dissociação de um ácido em água pode ser escrita como Ka = ([A- ] [H3O+ ]) / ([HA] [H2O]). III- Quanto maior o valor de Ka, maior é a força do ácido.
É correto o que se afirma em:
Considerando essa situação e o fato de que o experimento de titulação é uma das formas de se avaliar se uma solução apresenta propriedade tamponante, assinale a opção correta.
Desejando-se preparar um solução tamponada com pH 10,0, utilizando-se ácido bórico e borato de sódio, e sendo, para ácido bórico o pKa 9,24, calcule a razão, entre a base conjugada e o ácido, necessária para a preparação deste tampão.
O valor correto resultante do cálculo é
Sendo o Ka do ácido acético é 1,75 x 10-5 , calcule a concentração da solução de ácido acético e o pH após a adição de 18,00 ml de NaOH.
Os valores encontrados são, respectivamente,
Com base no exposto, são feitas as seguintes afirmações:
I. Os indicadores são compostos adicionados que sofrem uma alteração de cor ou turbidez sinalizando que o ponto final foi atingido. II. Os requisitos de um padrão primário são: alta pureza, baixa solubilidade no meio de titulação, massa molar razoavelmente alta e estabilidade à atmosfera. III. O ponto final de uma titulação de 1,00 mol de HCl é alcançado com a adição de 1,00 mol de Mg(OH)2.
Está(ão) corretas(s) a(s) afirmativa(s)
pH = –log10[H+]
Considerando que uma amostra de sangue apresenta uma concentração iônica [H+] de 100,61 × 10–8 mol/L, qual é o pH dessa amostra de sangue?
As reações a seguir representam o sistema de tamponamento sanguíneo do bicarbonato.
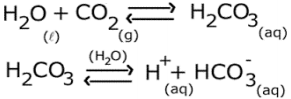
De acordo com as reações, o aumento de CO2 no sangue
resulta em
Julgue o item, relativos a ácidos e bases.
A solução‐tampão é aquela cujo pH é mantido constante quando pequenas quantidades de ácido ou base são adicionadas. Um tampão básico, que estabiliza soluções em pH > 7, é preparado com uma solução que contém CH3COOH e CH3CO2− .Julgue o item, relativos a ácidos e bases.
Indicadores ácido‐base são comumente utilizados nas
titulações de ácidos e bases, sejam fracos ou fortes. O
indicador é um ácido ou uma base cujas espécies
protonadas (ou desprotonadas) têm cores diferentes.
Em solução aquosa, o comportamento de um indicador
depende essencialmente do valor de pH.
Julgue o item, relativos a ácidos e bases.
Os ácidos fracos em solução aquosa não são
completamente dissociados, mas os ácidos com
constante de acidez (Ka) menor que 1 são
completamente dissociados para todas as
concentrações e podem ser considerados como ácidos
fortes.
Com relação à velocidade de reação química, a fatores que a influenciam e a assuntos correlatos, julgue o item
As expressões da constante de equilíbrio são muito
importantes porque permitem que os químicos possam
prever a direção e a extensão de uma reação química.
Contudo, uma expressão da constante de equilíbrio não
fornece informações relacionadas à velocidade na qual
o equilíbrio é alcançado.
Com relação à velocidade de reação química, a fatores que a influenciam e a assuntos correlatos, julgue o item
Pelo princípio de Le Chatelier, quando se exerce uma
ação sobre um sistema em equilíbrio dinâmico, ele se
desloca no sentido que produz uma minimização da ação
exercida. Em outras palavras, sempre que se aplicar um
esforço sobre um sistema em equilíbrio, a posição de
equilíbrio será alterada na direção que tende a
minimizar ou anular o efeito do esforço aplicado.
Julgue o item de quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
O carbonato de cálcio, presente no calcário, reage com o íon hidrônio, formando íons bicarbonato em água, conforme mostrado na equação seguinte.
CaCO3 (s) + H3O+ (aq) <=> HCO3 -(aq) + Ca2+ (aq) + H2O (l)