Questões de Concurso
Comentadas sobre equilíbrio químico em química
Foram encontradas 301 questões
Julgue o item de quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
A correção da acidez do solo pode ser realizada com a
aplicação de calcário (calagem) e tem como objetivo
ajustar o pH do solo.
Julgue o item de quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
Cavernas de calcário são formadas pela ação de dissolução das rochas calcárias pela água subterrânea, que contém dióxido de carbono, conforme a equação química a seguir.
CaCO2 (s) + H2O + CO (aq) --> Ca(HCO2)2 (aq)
[PCl5 ] 0,0456 Mol. L-1 [PCl3 ] 0,0211 Mol. L-1 [Cl2 ] 0,0121 Mol. L-1
Calcule o valor da constante de equilíbrio (em termos da concentração) em 170°C.
A concentração é uma característica importante para análise e interpretações de propriedades para as soluções e um dado necessário para seu uso no laboratório, na indústria e no cotidiano.
Abaixo, estão desenhados recipientes com os respectivos volumes de solução e massas de hidróxido de sódio (NaOH = 40g/mol).
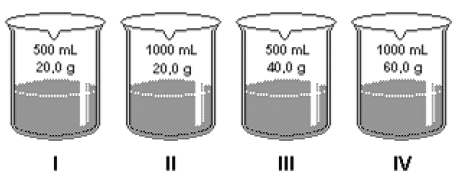
I. A solução contida no frasco I apresenta concentração de 1,0 mol/L;
II. As 4 soluções apresentarão pH acima de 7;
II. A solução mais concentrada está presente no frasco III.
São corretas as afirmações:
[H2]=1,83x10-3 mol/L, [l2]= 3, 12x10-3 mol/L e [HI]= 17,67 X 10-3 mol/L. 2 HI(g)
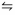 H2(g) + I2(g)
H2(g) + I2(g)
A figura I precedente mostra a variação do pH em função do volume de NaOH na titulação de 50,0 mL de uma solução de um ácido com uma solução de NaOH a 0,05 mol/L. A figura II mostra a segunda derivada da curva da figura I.
Considerando essas informações, assinale a opção correta a respeito
de volumetria e dos assuntos que esse tema suscita.
Texto 19A1BBB
Um caminhão contendo ácido sulfúrico (H2SO4) concentrado tombou e seu conteúdo vazou sobre a rodovia e atingiu um pequeno lago nas imediações. Nos dias que se seguiram ao acidente, a análise da água do lago detectou uma concentração analítica do ácido igual a 1,00 • 10 2 mol/L. Visando-se a neutralizar a acidez causada na água do lago, um produto químico foi utilizado.
Para responder à questão, considere que a solução formada tenha comportamento ideal, que inicialmente a água se encontrava com pH neutro, que a primeira ionização do ácido sulfúrico seja completa e a segunda ionização seja parcial, e assuma 0,30 como o valor de log 2.
Texto 19A1BBB
Um caminhão contendo ácido sulfúrico (H2SO4) concentrado tombou e seu conteúdo vazou sobre a rodovia e atingiu um pequeno lago nas imediações. Nos dias que se seguiram ao acidente, a análise da água do lago detectou uma concentração analítica do ácido igual a 1,00 • 10 2 mol/L. Visando-se a neutralizar a acidez causada na água do lago, um produto químico foi utilizado.
Para responder à questão, considere que a solução formada tenha comportamento ideal, que inicialmente a água se encontrava com pH neutro, que a primeira ionização do ácido sulfúrico seja completa e a segunda ionização seja parcial, e assuma 0,30 como o valor de log 2.
O indicador ácido-base azul de bromotimol apresenta as seguintes características em solução aquosa:
pH 1 cor amarela
pH 7 cor verde
pH 12 cor azul
Em um laboratório químico foram adicionadas gotas do indicador azul de bromotimol em cada um dos três tubos de ensaio identificados na figura.
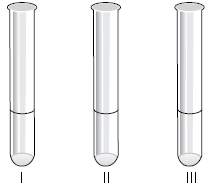
I. Soro fisiológico (solução aquosa de sal de cozinha e açúcar).
II. Solução aquosa de hidróxido de sódio.
III. Solução aquosa de ácido clorídrico.
É correto afirmar que as soluções dos tubos I, II e III apresentaram, respectivamente, as colorações:
A química ácido / base de muitos sistemas aquáticos naturais, incluindo rios e lagos, é dominada pela interação do íon carbonato, CO3 2-, uma base moderadamente forte, com ácido carbônico (H2 CO3 ), que é um ácido fraco. O ácido carbônico resulta da dissolução na água do gás carbônico e da decomposição da matéria orgânica na água. A fonte predominante de íon carbonato são as rochas calcárias, que são constituídas em grande medida por carbonato de cálcio (CaCO3 ). Embora esse sal seja quase insolúvel, uma pequena quantidade dele dissolve-se quando em contato com a água:
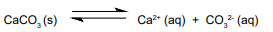
Considere que, em certa condição de temperatura do meio, a constante do produto de solubilidade (Kps) para o CaCO3 seja igual a 4 x 10–10. Nessas condições, qual é a massa de íon cálcio, em miligramas, dissolvida em 100 litros de solução?
Dado: massa atômica do cálcio = 40 u
Uma titulação entre uma base fraca e um ácido forte apresenta a curva de pH abaixo, onde S é o ponto estequiométrico (também chamado de ponto de equivalência).
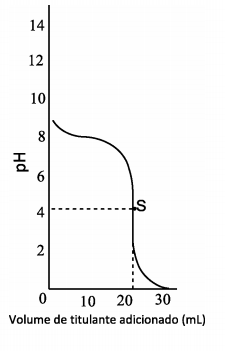
Sabendo que log 2 = 0,3 e considerando as opções apresentadas, o indicador mais eficiente para esta titulação é:
Para determinar a concentração de íons iodeto em 200 mL de uma solução, foi adicionado bromo, a fim de converter iodeto em iodato, de acordo com a reação:

Posteriormente, o íon iodato foi precipitado como iodato de bário, através da adição de íons bário:
Sabendo que se obteve, ao final do processo, 0,974 g de iodato de bário, calcule a concentração de iodeto na solução em
g/L. Massas molares (g/mol): O = 16; I = 127; Ba = 137.
Considere os ácidos abaixo

Um estudante prepara soluções aquosas desses ácidos com a mesma concentração molar. Sobre esses ácidos e as
espécies presentes nas soluções, é correto afirmar que:
Em um experimento, avaliou-se a seguinte reação química:

As concentrações iniciais de SO2 e O2 foram 0,3 mol/L e 0,2 mol/L, respectivamente. No início da reação, não havia SO3 no reator, mas atingido o equilíbrio, sua concentração foi igual a 0,2 mol/L.
Para esse sistema, a constante de equilíbrio, em termos
de concentrações, é igual a
Em um laboratório, estão disponíveis os seguintes sais:
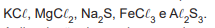
A dissolução de um desses sais em água acarretou a formação de uma solução aquosa com pH ácido.
O sal dissolvido correspondeu a
Considere a reação química indicada a seguir.
HCO3 – + H+ ---> H2 CO3 H2O + CO2
A reação, da forma como está apresentada, ocorre nos