Questões de Concurso
Comentadas sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 438 questões
Partindo das informações anteriores e considerando que MCO2 = 44,00 g/mol e MC10H15N = 149,00 g/mol sejam, respectivamente, as massas molares do CO2 e do C10H15N, e que a constante de Avogadro (NA) valha 6 × 1023 mol−1, julgue o item subsequente.
A soma das quantidades de matéria dos reagentes é igual à
soma das quantidades de matéria dos produtos.
Partindo das informações anteriores e considerando que MCO2 = 44,00 g/mol e MC10H15N = 149,00 g/mol sejam, respectivamente, as massas molares do CO2 e do C10H15N, e que a constante de Avogadro (NA) valha 6 × 1023 mol−1, julgue o item subsequente.
Para a eliminação completa de 16 mg de metanfetamina do
corpo, serão formados mais de 40 mg de gás carbônico,
considerando-se um rendimento de 80% desse processo.
A adição de sal light à água, para o preparo de macarrão, diminui a temperatura de ebulição e aumenta a pressão máxima de vapor d’água, por isso ela ferveria mais rápido nessas condições.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
A concentração de íons Cl−
na solução de sal light preparada
conforme o texto é inferior a 0,05 mol/L.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
Na solução de sal light preparada conforme o texto, estão
contidos 1,2 × 1022 íons de Na+
.
Para a obtenção de óxido de ferro (II), foi realizado um experimento em triplicata, envolvendo a queima de limalha de ferro. As massas, em gramas, de ferro e oxigênio usadas e os resultados do experimento estão relacionados no quadro a seguir.
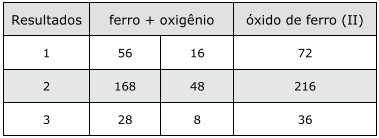
Com relação aos resultados obtidos, analise as afirmativas a seguir.
I - A razão das massas encontrada entre o ferro e o oxigênio é de 7/2.
II - No óxido de Fe(II), a proporção entre as massas de ferro e oxigênio será sempre constante.
III - A composição percentual de FeO será 70% de ferro e 30% de oxigênio.
Está(ão) correta(s)
O iso-octano é o constituinte que está em maior proporção na gasolina automotiva. Para que a combustão desse hidrocarboneto seja completa, de acordo com a equação, qual será a razão molar
C8H18 : O2?
Considere a equação não balanceada
C8H18(l) + O2(g) → CO2(g) + H2O (g)
A reação que ocorre entre o permanganato de potássio e os íons Fe2+, em meio ácido, é representada pela equação não balanceada
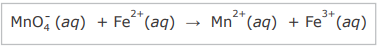
Em relação à reação, considere as afirmativas.
I - São necessários 4 íons H+ nos reagentes para balancear essa equação.
II - O íon Fe2+ é o agente redutor nessa reação.
III - O número de oxidação do íon manganês varia de +4 no reagente para +2 no produto.
Está(ão) correta(s)
Um laboratório recebeu uma amostra de calcário para que fosse analisado o seu grau de pureza. Pela decomposição de 240 g de calcário, foram produzidos 107 g
CaCO3 (s) → CaO (s) + CO2 (g)
A pureza encontrada, em percentagem, teve seu
valor mais próximo de
Cu(s) + NO3 – (aq) + H+ (aq) → Cu+2(aq) + NO(g) + H2O(l)
A soma dos menores inteiros que balanceiam corretamente a equação descrita é igual a
A Lei das Proporções Definidas é também conhecida como Lei de Proust. Esse estudioso observou que amostras de compostos diferentes, de massas iguais, contêm sempre a mesma proporção em massa dos seus elementos constituintes. Desse modo, as proporções em massa dos elementos constituintes são fixas para quaisquer compostos distintos.
A Lei da Conservação das Massas, ou Lei da Conservação da Matéria, é observada e difundida no meio científico pela realização de experimentos em recipientes fechados e com balanças precisas; a soma das massas antes de uma reação é igual à soma das massas após a reação.
É consenso entre os estudiosos da área que o início da química como área de conhecimento deu-se com o trabalho de Robert Boyle (1627-1691), considerado o “pai” da química.
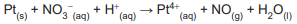
A soma dos coeficientes estequiométricos de reagentes e produtos na reação balanceada é
O processo de obtenção consiste na calcinação da mistura de sílica (SiO2) com carbonato de sódio (Na2CO3), produzindo o silicato de sódio e gás carbônico. Este processo apresenta rendimento de 70%.
A massa de silicato de sódio que poderá ser obtida por este processo, a partir de 3,0 kg de sílica, é: Dados: Massas molares em g.mol–1 Si = 28; O = 16; Na = 23; C = 12.
As armas de fogo são artefatos de dimensões e formas diversas que arremessam um ou mais projéteis utilizando a força de expansão de gases resultantes da combustão da pólvora. Atualmente se utilizam pólvoras baseadas em nitrocelulose e nitroglicerina, mas antigamente as armas de fogo usavam a pólvora preta, cuja combustão é representada pela equação a seguir, que está desbalanceada:
S(sol.) + C(sol.) + KNO3 (sol.) → CO2 (g) + N2 (g) + K2S (sol)
A equação equilibrada estequiometricamente é
Acerca de estequiometria, julgue o item que se segue.
As bases fundamentais da estequiometria são a lei das
proporções definidas, a lei das proporções múltiplas e a lei
das proporções equivalentes.
Considerando-se que os óxidos são compostos inorgânicos com diversas aplicações na indústria química, julgue o item subsequente.
O químico francês Joseph Proust elaborou a lei da
conservação das massas.
Em relação a essa operação é correto dizer que