Questões de Concurso
Comentadas sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 292 questões
A análise centesimal de uma amostra resultou em: 54,5% de carbono, 9,1% de hidrogênio e 36,4% de oxigênio. A fórmula mínima do composto na amostra é
A matéria é feita de elementos que são substâncias que não podem ser decompostas em outras substâncias por reações químicas. A partir deste contexto, analise as proposições a seguir.
I- Cobre, carbono e oxigênio são exemplos corretos das substâncias descritas no contexto.
II- O ouro possui propriedades diferentes dos elementos descritos, conhecidas desde a Idade Média pelos alquimistas.
III- Quando duas ou mais destas substâncias se juntam, forma-se um composto, com características diferentes das características dos seus elementos constituintes, tal como a água, por exemplo.
IV- Quatro destas substâncias formam a maior parte da matéria viva: carbono (C), hidrogênio (H), oxigênio (O) e nitrogênio (N).
É CORRETO o que se afirma em:
Durante uma titulação ácido-base, 25,0 mL de uma solução de ácido clorídrico (HCl) 0,100 M é neutralizada com 35,0 mL de uma solução de hidróxido de sódio (NaOH) de concentração desconhecida. Qual é a concentração da solução de NaOH?
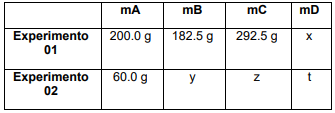
Os valores, em gramas, de x, y, z e t são, respectivamente:
Qual das alternativas descreve corretamente o que ocorre durante essa reação?
Dados: C = 12,01; H = 1,01; Br = 79,91
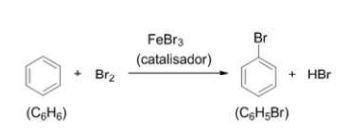
Determine o rendimento teórico do bromo-benzeno, quando 30 g de benzeno reage com 65 g de bromo.
Assinale a alternativa que apresenta a reação balanceada corretamente.
Qual a classificação desta reação e a função do ácido sulfúrico no processo de obtenção do nitrobenzeno, respectivamente?
KClO3
 KCl + O2
KCl + O2 Após efetuar o balanceamento da equação acima, e considerando os conceitos sobre cálculos estequiométricos, analise as afirmativas a seguir e assinale a alternativa correta.
Para fins de cálculo, as massas moleculares em g/mol são: H=1; O=16; S=32.
Em relação aos parâmetros avaliados em uma curva de padrão, associe cada definição ao termo mais adequado.
1. Linearidade
2. Precisão
3. Sensibilidade
( ) Capacidade de um método detectar pequenas mudanças na concentração do analito.
( ) Concordância entre os resultados de medições repetidas da mesma amostra.
( ) Capacidade do procedimento produzir resultados diretamente proporcionais à concentração do analito na amostra, dentro de um intervalo especificado.
Assinale a opção que indica a relação correta na ordem apresentada.
2Mg + O2 → 2MgO
Com essa reação foram realizados dois experimentos cujos dados constam nesta tabela:
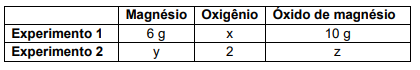
Utilizando as leis ponderais, é correto afirmar que os valores de x, y e z, em gramas, que completam, correta e respectivamente, a tabela são
Para cada mol de ácido fosfórico, são necessários três mols de hidróxido de sódio para produzir um mol de fosfato de sódio (Na₃PO₄) e três mols de água.
O hidrogênio tem capacidade de reagir com metais ativos para formar hidretos metálicos sólidos, como, por exemplo: 2Na(s) + H2(g) → 2NaH(s).
(1) Combustão. (2) Decomposição.
( ) 2H2O2 → 2H2O + O2 ( ) 2KBrO3 → 2KBr + 3O2 ( ) CH4 +2O2 → 2H2O + CO2
Fonte: MOLINARO, E.; CAPUTO, L.; AMENDOEIRA, R. Conceitos e métodos para formação de profissionais em laboratório de Saúde. Rio de Janeiro: EPSJV; IOC, 2009.
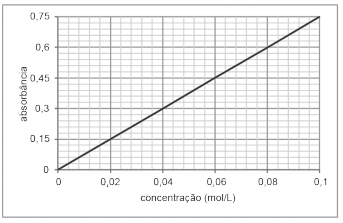
Uma amostra correspondendo a uma solução aquosa contendo Cu+2 passou pelo seguinte procedimento: uma alíquota de 10 mL dessa amostra foi completamente diluída em água até atingir um volume final de solução de 50 mL; uma alíquota dessa solução foi analisada no espectrômetro obtendo-se uma absorbância igual a 0,45.
A concentração de Cu+2 na amostra inicial, em mol L-1 , é