Questões de Concurso
Comentadas sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 766 questões
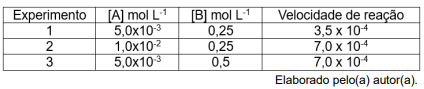
De acordo com os dados apresentados, a lei de velocidade para a reação estudada é:
Use: R = 0,082 atm . L . mol-1 K-1
Massas Molares: O = 16,0 g mol-1; C = 12 g mol-1; H = 1 g mol-
2 Fe + Cl2 = 2 FeCl3
Qual é o coeficiente estequiométrico adequado a ser colocado antes de Cl2 para balancear a equação?
a PhCH 3 + b KMnO 4 + c H2SO 4 = d PhCOOH + e K2SO4 + f MnSO 4 + g H2O
(__) A soma dos coeficientes estequiométricos a + b + c = 20.
(__) A soma dos coeficientes estequiométricos a + d + f = 16.
(__) A soma dos coeficientes estequiométricos b + e + g = 23.
Assinale a alternativa que apresenta a sequência correta:
2 C6H5COOH + O2 = 14 CO2 + 6 H2O
Qual é o coeficiente estequiométrico adequado a ser colocado antes de O2 para balancear a equação?
I. Na2CO3 + HCl → NaCl + H2O + CO2
II. Al + H2SO4 → Al2(SO4)3 + H2
As equações acima não estão balanceadas; balanceie-as e assinale a alternativa que corresponde aos respectivos coeficientes estequiométricos.
Em relação à análise instrumental, julgue o item a seguir.
A lei de Beer-Lambert relaciona a absorvância à
concentração do soluto e ao caminho óptico (espessura da
célula), valendo-se, para tanto, do coeficiente de absorção
molar (ou coeficiente de extinção molar).
Com relação a essa situação hipotética, julgue o item seguinte, considerando que todos os gases se comportem idealmente, que não haja processo de liquefação ou vaporização e que 0 K = −273 °C.
Se o referido GNV for totalmente transferido para outro
botijão à mesma temperatura e, nesse novo botijão, a pressão
final dos gases for de 30 MPa, então o volume gasoso desse
novo botijão será de 10 m3
.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
Se a fração molar de metano (CH4) no gás natural for igual
a 70%, então, em um botijão de gás natural sob a pressão
de 680 kPa, a pressão parcial do metano será superior
a 500 kPa.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
A pressão da mistura de hidrogênio e gás natural será igual à
soma da pressão parcial do hidrogênio e das pressões
parciais dos gases que compuserem o gás natural.
A partir dessas informações e considerando que MH = 1 g/mol, MC = 12 g/mol, e MO = 16 g/mol, que o volume molar de um gás ideal seja de 22,4 L e que todos os gases se comportem de forma ideal, julgue o item a seguir.
Para a combustão completa de 0,2 kg de n-heptano, o
volume mínimo necessário de O2, nas CNTP, é de 44,8 L.
A partir dessas informações e considerando que MH = 1 g/mol, MC = 12 g/mol, e MO = 16 g/mol, que o volume molar de um gás ideal seja de 22,4 L e que todos os gases se comportem de forma ideal, julgue o item a seguir.
Para que 0,2 mol de n-heptano seja totalmente consumido
na queima, a massa de O2 disponível deve ser maior ou igual
a 70,4 g.
A partir dessas informações e considerando que MH = 1 g/mol, MC = 12 g/mol, e MO = 16 g/mol, que o volume molar de um gás ideal seja de 22,4 L e que todos os gases se comportem de forma ideal, julgue o item a seguir.
A massa de H2O (g) produzida pela queima de 500 g desse
combustível, com excesso de O2, é maior que 700 g.
A partir dessas informações e considerando que MH = 1 g/mol, MC = 12 g/mol, e MO = 16 g/mol, que o volume molar de um gás ideal seja de 22,4 L e que todos os gases se comportem de forma ideal, julgue o item a seguir.
Quando 1 mol do gás n-heptano é queimado com excesso
de O2, 5 mol de CO2 (g) são formados.