Questões de Concurso
Comentadas sobre propriedades coligativas: tonoscopia, ebulioscopia, crioscopia e pressão osmótica. em química
Foram encontradas 68 questões
Em uma aula experimental de química, três soluções foram submetidas à destilação. O gráfico a seguir representa o comportamento dessas soluções.
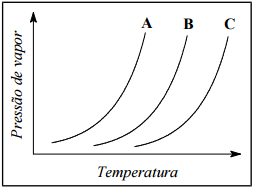
Este gráfico evidencia o ponto de ebulição
I. O metal mercúrio flutua na água. II. É líquido na temperatura ambiente. III. Na tabela periódica, ele é considerado elemento de transição. IV. A uma temperatura de 0ºC, ele se encontra no estado sólido.
Está(ão) correta(s):
A definição; “é o gás natural no estado líquido obtido mediante processo de criogenia a que foi submetido e armazenado em pressões próximas à atmosférica”; corresponde ao conceito de:
I - Em uma cidade como Poços de Caldas, localizada a 1.196 metros acima do nível do mar, a temperatura de ebulição da água, em panela aberta, é superior a 100 °C como consequência da pressão atmosférica em Poços de Caldas ser maior que ao nível do mar. II - Na panela de pressão fechada, a água entra em ebulição acima de 100 °C graças à retenção de parte do vapor produzido, que gera aumento da pressão interna. III - Considerando três frascos iguais e fechados, numa mesma localidade, contendo volumes diferentes de água e todos mantidos à mesma temperatura, a pressão de vapor de água nos três frascos será a mesma em todos eles, desde que a quantidade de líquido colocada em cada um seja suficiente para que a quantidade de vapor formado atinja a pressão de vapor.
Está correto o que se afirma em
Deseja-se dessalinizar 1 m3 de água do mar a 25 °C. A pressão osmótica (em atm) a ser aplicada no sistema dessalinizador, considerando-se apenas os íons Na+ e Cℓ − presentes nessa água, é
Dados:
Constante universal dos gases: 0,082 atm . L . mol−1 . K−1
Concentração do sal na água do mar a 25 °C = 2,95 g.L−1
Massas molares (g . mol−1): Na = 23; Cℓ = 35,5
Considerar o NaCℓ totalmente ionizado para cálculo da constante de Van’t Hoff.
Sobre soluções e propriedades coligativas julgue as afirmativas a seguir.
I. Ponto de orvalho é o nome dado ao ponto de saturação do vapor de água no ar atmosférico.
II. Uma solução de cloreto de sódio em água congela acima da temperatura de congelamento da água pura.
III. É possível separar soluto e solvente de uma solução verdadeira por meio de filtração simples.
IV. Existe liga metálica que é exemplo de uma solução sólida.
V. O aumento da temperatura promove o aumento da solubilidade de gases em líquidos.
Está correto o que se afirma apenas em:
Quando adicionamos um soluto não volátil a um solvente, a solução obtida apresenta propriedades diferentes do solvente puro. A intensidade com que essas propriedades ocorrem depende unicamente da quantidade de partículas proveniente do soluto não-volátil presente na solução, mas não depende da natureza dessas partículas. Dadas as concentrações das soluções aquosas abaixo, qual apresenta a menor pressão máxima de vapor?
I – 2x10-2 M de C12H22O11
II – 2 x10-2 M de HBr
III – 2 x10-2 M de C6H12O6
IV – 2x10-2 M de NaNO3
V – 2 x10-2 M de (NH4)2SO4
ΔT = kcM
onde kc é a constante crioscópica e M é a molalidade total das espécies em solução.
Considere soluções aquosas de e concentrações 5,0x10–3 mol.kg –1 com solutos totalmente dissociados: nitrato de potássio (KNO3) , cloreto de cálcio (CaCl2), nitrato de cádmio ( (Cd(NO3)2), cloreto férrico (FeCl3) e nitrato de alumínio (Al(NO3)3).
A s solução que apresentará o menor abaixamento crioscópico é a do
A pressão de vapor das soluções e dos componentes que as formaram é maior na(o)
Dados
ponto de ebulição da água a 1 atm = 100 o C
ponto de ebulição do etanol a 1 atm = 78 o C
Considere que essa propriedade depende do número de espécies (moléculas ou íons) dispersas na solução, e que 1 mol de sal se dissocie 100% nos seus íons ao ser dissolvido em 1.000 g de água.
Sendo assim, dentre as soluções abaixo, aquela que apresenta maior ponto de ebulição é
(Dados: C=12 / H=1 e O = 16)