Questões de Concurso Comentadas sobre química
Foram encontradas 7.276 questões
No que se refere ao cenário atual do Brasil e do mundo, julgue o item.
O chamado efeito estufa é ampliado pela emissão de
gases poluentes na atmosfera, fator este que é
resultante do modelo de industrialização adotado
mundialmente.
Um dos radionuclídeos do Radônio é 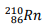 que decai emitindo
partículas alfa (α) para um dos isótopos do Polônio.
que decai emitindo
partículas alfa (α) para um dos isótopos do Polônio.
Uma reação que representa esse processo de desintegração nuclear é dada por:
Após a leitura, assinale a opção que mostra O SOMATÓRIO DOS COEFICIENTES ESTEQUIOMÉTRICOS, expressos com os menores inteiros, da reação citada na etapa 1 acima, A GEOMETRIA MOLECULAR da arsina e o ESTADO DE OXIDAÇÃO (Nox) do arsênio no ácido arsênico, respectivamente:
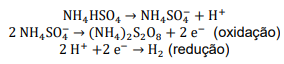
A hidrólise do persulfato de amônio forma H2O2:
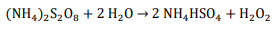
Se a eficiência do processo eletrolítico é de 60% assinale a opção que mostra a INTENSIDADE DE CORRENTE necessária para produzir 97 g de H2O2 por hora: Dados eventualmente necessários: constante de Faraday = 96500 C/mol; massas molares (g/mol): N = 14; O = 16; H = 1; S = 32.
I. Suporta elevadas temperaturas, tem formato arredondado e permite aquecimento uniforme. Essa vidraria é utilizada em processos de destilação, sistemas de evaporação a vácuo e refluxo;
II. É utilizada para medição de volumes, em que não é requerida precisão, e a presença de um bico facilita a transferência de líquidos. Essa vidraria é de uso geral e é útil para realizar misturas e dissolver substâncias em experimentos;
III. É utilizada para medir e transferir líquidos, podendo ser possível controlar o escoamento do material, rápido ou por gotejamento, pois a torneira na extremidade da vidraria permite fazer esse controle. Essa vidraria é amplamente utilizada em titulações, para comportar a substância titulante;
IV. É utilizada para preparar soluções, armazená-las e realizar experimentos que necessitem de aquecimento. Em processos de titulação, essa vidraria geralmente é utilizada para comportar a substância que vai ser titulada.
Com base na análise dos itens I a IV, assinale a opção CORRETA:
Na sequência o iodo foi titulado com tiossulfato de sódio a 0,100 mol/L até o ponto final, com o gasto de 30,00 mL de titulante. Esta última reação foi: I2 + 2 S2O2-3(aq) ➝ 2 I-(aq) + S4O2-6(aq).
Diante das informações, assinale a opção que mostra A PORCENTAGEM EM MASSA DE ZINCO NA AMOSTRA de latão: Dados: massas molares (g/mol): Cu = 63,5; Zn = 65,4.
I. A uma temperatura fixa, uma solução aquosa saturada de um determinado soluto sempre contém uma quantidade fixa desse soluto;
II. Todos os líquidos fervem a uma temperatura superior ao seu ponto de ebulição normal quando contêm impurezas não voláteis;
III. Toda solução comporta-se como uma solução ideal.
Com base na análise dos itens I, II e III, assinale a opção CORRETA:
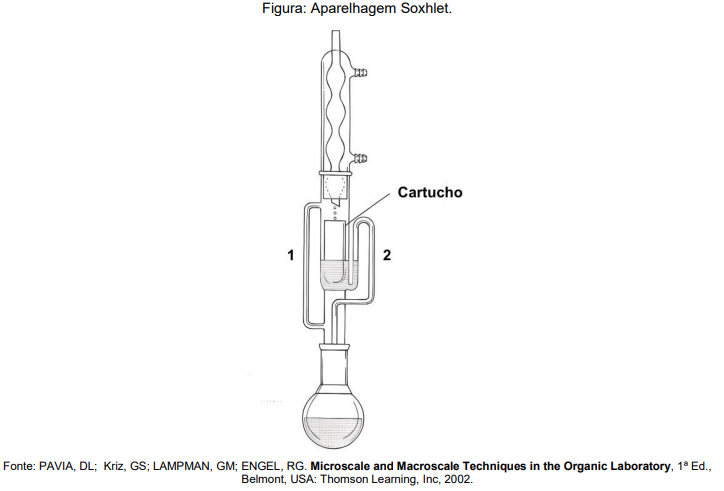
A respeito da aparelhagem mostrada e da técnica de extração com Soxhlet, assinale a opção CORRETA:
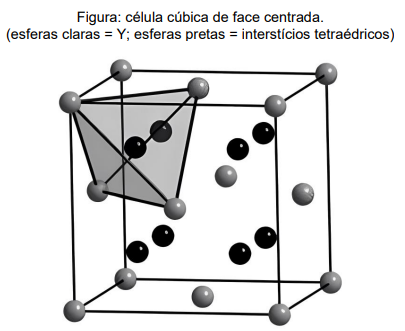
Sabe-se que, na célula apresentada, 1/8 (um oitavo) dos elementos nos vértices contribuem efetivamente para o retículo, enquanto os elementos nas faces contribuem com 1/2 (um meio). Diante das informações citadas, assinale a opção que mostra o número de INTERSTÍCIOS TETRAÉDRICOS, na célula cúbica mostrada, OCUPADOS PELO ELEMENTO X:
Tabela: Dados obtidos na investigação cinética (método da velocidade inicial) para a reação: 2 A2B(g) → 2 A2(g) + B2(g).
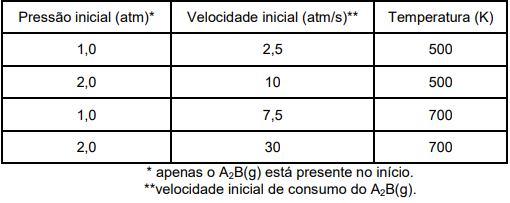
Diante das informações acima, assinale a opção que mostra A VELOCIDADE DA REAÇÃO (em termos de consumo do A2B(g)), em atm/s, quando a pressão de A2B(g) é igual a 1,5 atm à temperatura de 600 K:
Diante das informações e a partir dos seus conhecimentos, assinale a opção que mostra aproximadamente O VALOR DO pOH de uma solução de pH 8,50, a 37 °C:
Dados: densidade da água = 1000 g/L; massa molar da água = 18 g/mol; log(1,73) = 0,24; log(3) = 0,48.
Diante dessas informações, assinale a opção que mostra O VALOR DA CONSTANTE DE EQUILÍBRIO, Kp, para a reação de dimerização e a afirmação CORRETA que expressa a influência da pressão (FAVORECE OU DESFAVORECE) na dimerização: