A reação de decomposição de um composto gasoso de fórmula mo...
Próximas questões
Com base no mesmo assunto
Ano: 2023
Banca:
COPESE - UFPI
Órgão:
UFPI
Prova:
COPESE - UFPI - 2023 - UFPI - Técnico de Laboratório - Química |
Q2210806
Química
A reação de decomposição de um composto gasoso de fórmula molecular A2B ocorre segundo a equação
química: 2 A2B(g) → 2 A2(g) + B2(g). Os dados mostrados na Tabela abaixo foram coletados num estudo da
cinética dessa reação, através do método da velocidade inicial. Neste estudo, concluiu-se que: 1) o mecanismo
reacional (em termos das etapas elementares) é o mesmo entre as temperaturas de 500 e 700 K; e 2) a
magnitude da constante de velocidade, entre as mesmas temperaturas, é diretamente proporcional à
temperatura absoluta.
Tabela: Dados obtidos na investigação cinética (método da velocidade inicial) para a reação: 2 A2B(g) → 2 A2(g) + B2(g).
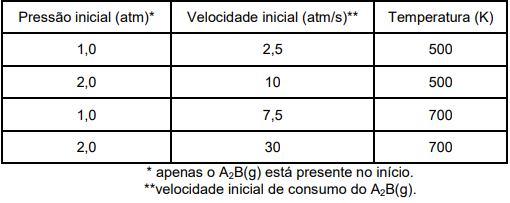
Diante das informações acima, assinale a opção que mostra A VELOCIDADE DA REAÇÃO (em termos de consumo do A2B(g)), em atm/s, quando a pressão de A2B(g) é igual a 1,5 atm à temperatura de 600 K:
Tabela: Dados obtidos na investigação cinética (método da velocidade inicial) para a reação: 2 A2B(g) → 2 A2(g) + B2(g).

Diante das informações acima, assinale a opção que mostra A VELOCIDADE DA REAÇÃO (em termos de consumo do A2B(g)), em atm/s, quando a pressão de A2B(g) é igual a 1,5 atm à temperatura de 600 K: