Questões de Concurso Comentadas sobre química
Foram encontradas 7.320 questões
Correlacione os grupos funcionais com os exemplos de compostos.
Grupos funcionais
I. Álcool
II. Éter
III. Cetona
IV. Amina
Exemplos de compostos
A. CH3-N H -CH3
B. CH3-CH2-OH
C. CH3-CO -CH3
D. CH3-O -CH3
Assinale a alternativa que apresenta a correlação correta.
O tolueno (C7H8) é um hidrocarboneto líquido (densidade 0,87 g mL-1) em condição ambiente, que é usado como solvente de tintas, e como antidetonante em misturas combustíveis. O tolueno reage completamente com oxigênio, conforme indicado na equação:
2 C7H8(ℓ) + 18 O2(g) → 14 CO2(g) + 8 H2O(g) : AH° = - 7 500 kJ
Se a queima completa, e em excesso de oxigênio, de uma determinada quantidade de tolueno produziu energia na forma de calor igual a -30.000 kJ, então o volume de tolueno que reagiu (em L e com dois algarismos significativos) foi
Dado
M (C7H8) = 92,0 g mol-1
Uma amostra contém Ba2+ e Ca2+ nas concentrações de 1 x 10-2 mol L-1 para cada íon. Esses íons devem ser precipitados na forma de sulfatos pouco solúveis, como apresentado nas equações abaixo.
BaSO4(s) ⇌ Ba2+(aq) + SO42-(aq) ; Kps1 = 1 x 10-10
CaSO4(s) ⇌ Ca2+(aq) + SO42-(aq) ; Kps2 = 1 x10-5
Quando a concentração de SO42- atingir um valor para permitir o início da precipitação do CaSO4, a concentração de Ba2+ na solução estará na ordem de grandeza, em mol L-1, de
Nanopartículas esféricas de ouro são estruturas que contêm centenas de átomos de Au. A superfície dessas nanopartículas apresenta carga elétrica advinda de uma camada de íons provenientes do reagente usado na redução do Au3+ para o Au que forma a nanopartícula. A elevada relação superfície-volume e a carga superficial mantêm as nanopartículas dispersas homogeneamente no meio aquoso.
Considerando que cada uma das nanopartículas tenha 100 átomos de Au e que a concentração de Au3+ na reação que originou a dispersão era de 1 x 10-6 mol L-1, o número de nanopartículas de ouro em 5 mL de dispersão aquosa será de
Dado
1 mol de átomos = 6 x 1023 átomos
O gás dióxido de enxofre (SO2) reage com o gás NO2 formando o trióxido de enxofre, que promove a acidificação da água da chuva.
SO2(g) + NO2(g) ⇌ SO3(g) + NO(g)
A constante de equilíbrio (Kc) dessa reação é igual a 25 a 400 K. Nessas condições, coloca-se em um reator, de volume fixo, a quantidade de gases necessária para se ter, inicialmente, 1 mol L-1 de cada um dos quatro gases.
Ao se atingir o equilíbrio, a concentração de SO3(g) no sistema, em mol L-1, será mais próxima de
O clorato de potássio (KClO3), quando aquecido, se decompõe segundo a equação química abaixo.
2 KClO3(s) → 2 KCℓ(s ) + 3O2(g)
Uma mistura com massa desconhecida contém apenas KCℓO3 e KCℓ e foi aquecida produzindo 0,175 mol do gás oxigênio proveniente da reação de decomposição completa do KCℓO3. Após o aquecimento, a massa final de KCℓ foi de 25,0 g.
Dessa forma, a massa total aproximada, em gramas, da mistura que foi aquecida era de
Dados
M(KCℓ) = 75 g mol-1
M (KCℓO3) = 123 g mol-1
Os hidrocarbonetos representados a seguir, e identificados por I, II e III, são compostos orgânicos relativamente simples, pois são constituídos exclusivamente por átomos de carbono e hidrogênio.
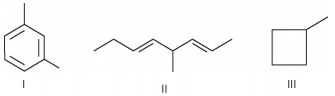
Os compostos I, II e III correspondem aos tipos
Considere as seguintes equações químicas de oxirredução balanceadas a seguir:
Fe2O3(s) + 3 CO(g) → 2 Fe(s) + 3 CO 2(s) (I)
2 K(s) + 2 H2O(ℓ) → 2 KOH(aq) + H2(g) (I)
2 NaBr(aq) + Cℓ2(g) → 2 NaCℓ(aq) + Br2(ℓ) (III)
Em cada uma das equações, o agente oxidante é a espé
cie química:
Policaprolactona, cuja sigla é PCL, é um polímero biodegradável muito utilizado como aditivo em resinas, e acrilonitrila-butadieno-estireno, cuja sigla é ABS, é um polímero que possui elevada resistência, portanto, é utilizado na fabricação de capacetes, entre outros objetos.
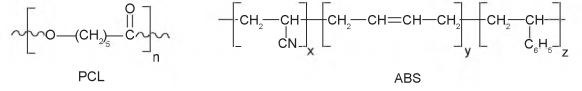
PCL e ABS são, respectivamente:
Uma solução aquosa de bicarbonato de sódio (NaHCO3) foi preparada em um balão volumétrico de 250,00 mL utilizando-se 10,0 g do soluto, com o volume final ajustado pela adição de água pura. Dessa solução foi retirada uma alíquota de 25,00 mL, que foi transferida para um balão de 100,00 mL, no qual o volume final foi ajustado pela adição de água pura.
Os valores mais próximos das concentrações, em quantidade de matéria (mol L-1), da solução inicial e da solução após a diluição são, respectivamente,
Dado
M (NaHCO3) = 84,0 g mol-1
O tricloreto de fósforo (PCℓ3) é um composto químico muito utilizado como matéria-prima para obtenção de diversos compostos organofosforados. Ele é comumente preparado, sob condições adequadas, de acordo com a equação química balanceada representada a seguir.
P4(s) + 6 Cℓ2(g) → 4 PCℓ3(l)
O valor mais próximo da massa, em gramas, de PCℓ3 que se formaria a partir de 12,4 g de P4 e 30,0 g de Cℓ2, considerando um rendimento de 100%, seria
Dados
M (P4) = 123,9 g mol-1
M (Cℓ2) = 70,9 g mol-1
M (PCℓ3) = 137,3 g mol-1
No processo industrial de soldagem oxi-acetilênica, o acetileno é preparado por uma reação entre o carbeto de cálcio e a água (R1). Além disso, a combustão do acetileno acontece em presença de oxigênio (R2). Considerando que o volume molar dos gases nas condições normais de temperatura e pressão é 22,7L/mol, ajuste os coeficientes estequiométricos e responda:
Qual será a massa de carbeto de cálcio necessária para produzir acetileno e encher um cilindro de 0,05 m3? Qual é a massa de oxigênio necessária para ocorrer a combustão total de 0,05 m3 de acetileno?
Massa atômica Ca= 40, C= 12, O= 16, H= 1 g/mol
CaC2(s) + H2O(I) → C2H2(g) + Ca(OH)2(s) R1
C2H2(g) + O2 → CO2(g) + H2O(g) R2
Os elementos 26Fe e 28Ni no estado oxidado podem formar compostos de coordenação. Quais são os orbitais hibridizados para cada complexo metálico abaixo:
Complexo 1= [Fe(CN)6]K3,
Complexo 2= [Ni(CN)5]K3,
Complexo 3=[Ni(NH3)6]Cl2
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

A papaverina é uma substância obtida da papoula e apresenta a estrutura ilustrada na figura abaixo.
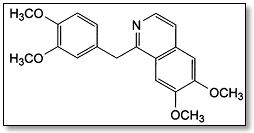
O grupo funcional predominante na papaverina é: