Questões de Concurso Comentadas sobre química
Foram encontradas 7.347 questões
O carbonato de cálcio reage com o ácido bromídrico produzindo brometo de cálcio de acordo com a reação apresentada abaixo:
CaCO3 + HBr → CaBr2 + H2O + CO2
Indique a massa, em gramas, de brometo de cálcio obtida quando 20 g de carbonato reagem com 15 g de ácido bromídrico. Considere que Ca = 40 u; C = 12 u; O = 16 u; H = 1u e Br = 80u.
I. A absorbância (A) de uma solução está relacionada com a transmitância de forma logarítmica, A=-log T. II. A absorbância é diretamente proporcional à concentração de uma espécie absorvente (c) e ao caminho óptico (b) do meio absorvente, A=εbc III. A constante de proporcionalidade chamada absortividade molar, à qual é dado o símbolo especial ε, é independente da natureza da espécie analisada. IV. Se a concentração é expressa em mols por litro e o caminho óptico em centímetros, então o coeficiente de absortividade molar possui as unidades de L mol-1cm-1.
Estão corretas APENAS as afirmativas
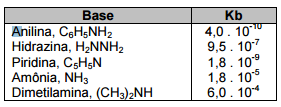
Analisando esses valores, é CORRETO afirmar:
Durante um procedimento de preparação de soluções no laboratório de alimentos, o analista precisa pesar a massa necessária para preparar as soluções abaixo descritas: (Dados: H=1; Na=23; C=12; O=16).
I - 500 mL de uma solução de concentração 0,02 N de carbonato de sódio (Na2CO3), que será utilizada para a padronização de soluções;
II - 1 litro de solução de ácido acético (C2H4O2) 0,025 M, que será usada para a titulação
de soluções.
As massas que devem ser pesadas para a preparação das soluções I e II, respectivamente ,
são:
Atenção: A questão refere-se ao conteúdo de Conhecimentos em Gás Natural.
O Gás Natural Liquefeito (GNL) é basicamente gás natural que, após purificado, é condensado ao estado líquido por meio da
redução da sua temperatura a −163 °C. A vantagem de se liquefazer o gás natural é
O ácido benzoico foi descoberto no século XVI e recebeu esse nome por ter sido extraído do benjoeiro.
Em 1875, Salkowski verificou que esse ácido atua como fungicida
e, desde então, o ácido benzoico vem sendo usado como
germicida na preservação de alimentos e como adjuvante
farmacológico anti-fúngico, normalmente em concentrações que
variam entre 0,05 a 0,15%. Trata-se de um composto de fórmula
molecular C7H6O2 (massa molar = 122 g.mo -1) pouco solúvel em
água.
-1) pouco solúvel em
água.
Em uma solução aquosa, comporta-se como um ácido fraco, com pKa = 4.
Uma solução aquosa de ácido benzoico em concentração 0,12%
(m/v) apresenta pH aproximadamente igual a
A reação 2HI(g) 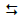 H2(g) + I2(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
H2(g) + I2(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
Assinale a opção que apresenta o valor correto da constante de
equilíbrio Kc.
A cinética da reação de brometo de benzila com benzilamina foi estudada por Ravi e colaboradores. Os autores verificaram que a reação é de primeira ordem com respeito a cada reagente.
A reação é esquematizada a seguir:
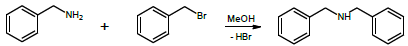
Em um experimento conduzido a 298 K, com excesso de benzilamina, o perfil de decaimento do brometo de benzila foi registrado, sendo apresentado na figura a seguir.
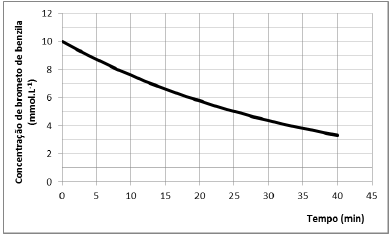
Nessas condições, o tempo (em minutos) em que a concentração
de brometo de benzila terá sido reduzida à 1/8 da concentração
inicial é de
Na determinação do teor de acidez de uma amostra de suco de laranja comercial, 10,00 mL de amostra foram levados para erlenmeyer. Adicionou-se água destilada até completar cerca de 50 mL, 3 gotas de fenolftaleína e titulou-se contra solução padrão de NaOH até mudança de coloração. Na titulação, foram gastos 3,90 mL de solução padrão 0,100 mol.L-1.
A acidez é expressa em termos do teor (porcentagem massa/volume) de ácido cítrico, cuja fórmula estrutural é apresentada a seguir.
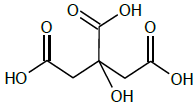
Assinale a opção que expressa a acidez da amostra.
Dados. Massa molar. Ácido Cítrico: 192 g.mol-1.
 : 74,5; BaSO4: 233
: 74,5; BaSO4: 233“Após a descoberta do elétron, não seria possível ainda conceber um átomo como uma esfera rígida, indivisível, mas como uma esfera ou nuvem de carga positiva, na qual os elétrons estariam embebidos, uniformemente distribuídos.”
Esse conceito de átomo é atribuído a
O cloreto de tionila, composto inorgânico com a fórmula SOC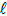 2 ,
é um reagente químico muito usado em reações de cloração. É
um líquido incolor, destilável à temperatura ambiente que
decompõe-se acima de 140ºC. É um composto de S(IV) formado
por ligações químicas de natureza covalente.
2 ,
é um reagente químico muito usado em reações de cloração. É
um líquido incolor, destilável à temperatura ambiente que
decompõe-se acima de 140ºC. É um composto de S(IV) formado
por ligações químicas de natureza covalente.
Assinale a opção que melhor representa a estrutura geométrica
de equilíbrio do cloreto de tionila.
A análise da concentração de ortofosfato em corpos d’água pode ser feita utilizando o método colorimétrico. Nesse método, o reagente combinado contendo K(SbO)C4H4O6, (NH4)6Mo7O24 e ácido ascórbico reage em meio ácido com o ortofosfato, produzindo uma cor azul, cuja intensidade é determinada no espectrofotômetro.
No preparo de 100 mL do reagente combinado utiliza-se 5 mL de uma solução de K(SbO)C4H4O6 3,5 g.L-1 e 15 mL de uma solução de (NH4)6Mo7O24 40 g.L-1.
Nessa solução do reagente combinado as concentrações
aproximadas (em g.L-1 ) de K(SbO)C4H4O6 e de (NH4)6Mo7O24 são,
respectivamente,