Questões de Concurso Comentadas sobre química
Foram encontradas 7.345 questões
Qual é a concentração de cobre, em mg/L, na amostra?
NÃO é um procedimento de separação a
Se a pressão total do sistema é de 4,5 atm, qual é a pressão parcial, considerando comportamento ideal dos gases, em atm, exercida pelo hélio nessa mistura?
Dados
M(He) = 4g/mol
M(N2) = 28g/mol
Qual é, aproximadamente, o volume, em L, ocupado por essa massa de 13 kg?
Se a temperatura da mistura é de 27 °C, a pressão, em atm, é, aproximadamente, de
Dados: Constante universal dos gases R = 0,082 L.atm.K−1 .mol−1 Peso atômico do hidrogênio = 1 Peso atômico do oxigênio = 16 Peso atômico do nitrogênio = 14
2AL(s)+Fe2O3(s) →Al2O3(s)+2Fe(s)
Qual é o calor de reação do Al2O3 (s) e qual é a classificação da reação quanto ao calor calculado?
Associe o tipo de reação orgânica com o processo e o produto a ela relacionados. Tipo de reação orgânica:
I- Substituição eletrofílica
II- Polimerização
III -Saponificação
IV - combustão
Processos
M - processo de produção de nitrobenzeno a partir de benzeno e ácido nítrico.
N - processo reacional que ocorre com ácido graxo e uma base na presença de calor formando um sal de ácido graxo e álcool.
P - processo de produção de dióxido de carbono e água a partir de etanol na presença de oxigênio.
Q - processo de hidrogenação catalítica de óleos e gorduras.
R - processo reacional de produção de politetilenotereftalato e água a partir de ácido tereftálico e etilenoglicol.
Um químico dispõe de duas soluções estoque de NaC, uma de 1,7 mol/L (solução I) e outra de título 25% e densidade 2 g/mL (solução II), para preparar 500 mL da solução de cloreto de sódio 10% p/v.
Os volumes das soluções I e II para o preparo da solução desejada, quando usados separadamente são, respectivamente,
Dado:1 mol de NaCl corresponde a 58, 5 g de Nacl
I. Precisão e exatidão têm o mesmo significado.
II. Limite de detecção é a menor concentração do analito que pode ser quantificada.
III. A linearidade correlaciona a resposta do método de quantificação com concentração conhecida da substância a ser analisada.
IV. A seletividade avalia o grau de interferência de outros ingredientes na amostra.
Assinale:
I. Devem ser importados e com alto grau de pureza
II. A validação analítica tem como objetivo final proporcionar confiabilidade aos resultados obtidos.
III. As vidrarias usadas nas análises devem ser limpas, esterilizadas, não requerendo, assim, de aferição pela Associação de Normas Técnicas (ABNT).
IV. Os equipamentos e os padrões devem ser certificados.
Assinale:
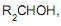 gera como produto um(a)
gera como produto um(a)Com relação a potenciais amostras líquidas a serem analisadas nesse sistema, sabe-se que elas são
Pb(NO3)2(aq) + Na2SO4(aq) → PbSO4(s) + 2NaNO3(aq)
A quantidade máxima de sulfato de chumbo II que pode ser obtida a partir da reação de 6,62 g de Pb(NO3)2 com Na2SO4 em excesso é, aproximadamente, em g, igual a Dados: M(Pb(NO3)2) = 331 g/mol M(PbSO4) = 303 g/mol
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
Dados: Ligação Energia de ligação (∆H) C – H 412 kJ/mol C – Cl 432 kJ/mol Cl – Cl 230 kJ/mol H – Cl 419 kJ/mol
Considerando que o rompimento de ligação é um processo endotérmico e que a formação de ligação é um processo exotérmico, qual a variação de entalpia, em kJ/mol, dessa reação?
K2Cr2O7(aq) + SnCl2(aq) + HCl(aq) → CrCl(aq) + SnCl4(aq) + KCl(aq) +H2O(l)
Nessa reação, o