Questões de Concurso Sobre química
Foram encontradas 13.490 questões
1) Dissolvendo-se em água 51,0 g em um balão de 250 ml (completado até a marca). 2) Em seguida, uma amostra de 2,00 ml desta solução foi transferida para um balão volumétrico de 100 ml e diluída com água até a marca. 3) Uma segunda diluição foi feita a partir da solução do item 2, transferindo-se 125 ml para um balão de 250 ml e diluída com água até a marca.
Com esses dados em mãos, analise as afirmativas a seguir.
I. A concentração final da solução na Etapa 1 é de 8 mol.l-1. II. A concentração da solução após a primeira diluição (Etapa 2) é aproximadamente 0,016 mol.l-1. III. A concentração da solução após a segunda diluição (Etapa 3) é aproximadamente 0,008 mol.l-1.
Estão corretas as afirmativas:
I. Material nutriente preparado para o crescimento de microorganismos em laboratório. II. É um meio de cultura de formulação única (universal) para qualquer tipo de fungos ou bactérias. III. Devem ser estéreis, devendo ser auto-clavados. IV. Os meios de cultura líquidos são mais utilizados como meios nutrientes enquanto os meios sólidos contém agar e são utilizados para verificação da morfologia das culturas.
Estão corretas as afirmativas:
Assinale a alternativa que contém a massa (em gramas) necessária para produzir 500 mL solução estoque.
A massa de NaOH (em g) necessária para preparar a solução é:
I. Em ambos os modelos, os elétrons encontram-se em órbitas circulares, em um raio fixo. II. Ambos os modelos, os elétrons são vistos como ondas, ao invés de partículas. III. Em ambos os modelos, a energia de um elétron é quantizada, ou seja, ele pode receber ou emitir determinados valores "permitidos". IV. No modelo de Bohr, o elétron é visto como partícula, no modelo quântico, como onda. V. A energia dos elétrons e suas posições nos orbitais podem ser descritas com a equação de onda Schrödinger.
Estão corretas as afirmativas:
( ) A pressão total do sistema é maior que a soma das pressões parciais dos gases do experimento. ( ) A quantidade de matéria total no recipiente é a soma do número de mols de cada gás do recipiente. ( ) A pressão parcial de cada gás (Pi) é dado pela fração (ni/ntotal) da pressão final, representada pela equação Pi = Xi.P, onde Xi = ni/ntotal.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
I. As partículas se comportam tanto como onda e como partícula. II. As moléculas não influenciam umas às outras, nunca. III. As moléculas de um gás são pontos infinitesimalmente pequenos. IV. Um gás consiste em uma coleção de moléculas em movimento aleatório contínuo.
Estão corretas as afirmativas:
1. 40,0 mg de Ar está confinado em um frasco de 0,0500 l a 27°C. 2. 40,0 mg de Kr está confinado em um frasco diferente de 0,0500 l a 27ºC.
A constante universal dos gases é 8,314462 L.kPa.K-1.mol-1. Massa molar aproximada: Ar = 40 g/mol, Kr = 80 g/mol.
Sobre o assunto, analise as afirmativas a seguir.
I. Para ter a mesma pressão do Ar, o Kr tem que estar a 600K. II. Para que os 2 gases tenham a mesma pressão, as temperaturas do Ar e do Kr devem ser iguais. III. O número de mol (n) do Kr é o dobro do número de mols do At.
Estão corretas as afirmativas:
I. A pressão final será menor que a inicial pois houve a diminuição da temperatura do experimento. II. A pressão final será maior apesar de haver a diminuição da temperatura do experimento. III. A pressão final será menor que a inicial, pois na reação que ocorre no experimento, o número de mols do gás diminui, conforme Lei de Avogadro. IV. Não há alteração na pressão final, pois com a reação que ocorre no experimento, o número de mols do gás diminui enquanto a pressão aumenta, um compensando o outro.
Estão corretas as afirmativas:
Considerando essa situação, assinale a alternativa que contenha as pressões finais dos dois gases corretas.
Considere a estrutura química da testosterona.
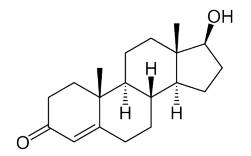
A massa molar para a estrutura química fornecida na imagem será, aproximadamente, de:
Dados de massas molares: C = 12 g/mol, H = 1 g/mol e O = 16 g/mol.
C2H6O + O2 → CO2 + H2O
Para a reação descrita, 3,0 g de C2H6O foi adicionado a um ambiente contendo 100,0 g de oxigênio. A massa (g) de CO2 produzida será, aproximadamente, de:
Dados de massas molares: C = 12 g/mol, H = 1 g/mol e O = 16 g/mol.
I. SO3 II. Al2O3 III. NO2 IV. Fe3O4 V. Na2O2 VI. Na2O
Sobre as propriedades dessas substâncias químicas, assinale a alternativa correta.
Dada a equação química
Fe + H2SO4 → Fe2(SO4)3 + H2
a soma de todos os menores coeficientes estequiométricos da
equação balanceada pelo método das tentativas é igual a