Questões de Concurso Sobre química
Foram encontradas 13.471 questões
NH3(g) + H2O(ℓ) ⇄ NH4+(aq) + OH-(aq)
Com relação à amônia e a sua reação com água, analise os seguintes itens:
I. A geometria molecular da amônia é piramidal. II. A amônia é dita como base de Bronsted-Lowry na reação com a água. III. NH4+ é a base conjugada da amônia.
Assinale a alternativa que contém a análise correta.
A respeito dos postulados de Bohr, analise os seguintes itens:
I. Cada elétron apresenta uma quantidade específica de energia.
II. Um elétron absorve ou irradia energia conforme salta de uma órbita para outra. Se um elétron absorveu energia significa que ele saltou para uma órbita mais próxima do núcleo.
III. Para que o elétron permaneça em sua órbita a atração eletrostática entre o núcleo e o elétron deve ser igual a força centrífuga.
Assinale a alternativa que contém a análise correta.
A ureia ((NH2)2CO) é um composto orgânico, sólido, cristalino e solúvel em água. Ela tem diversas aplicações, como na alimentação de bovinos, estabilizador de explosivos, produção de resinas e medicamentos e até nas sínteses de fertilizantes agrícolas.
Um dos meios de se obter a ureia e água é pela reação entre gás carbônico e amônia, nas condições adequadas.
Com base no texto, é correto afirmar que:
“Na nova fábrica, a água salobra e a água de processo pré-tratada da indústria são preparadas para a água doce. Isso é possível graças à combinação de diferentes técnicas de processamento da Apateq, incluindo software personalizado, desenvolvido ao longo dos anos”.
(Disponível em: https://tratamentodeagua.com.br/europa-reutilizacao-direta-agua/. Acessado em 28/09/2021)
Para este tratamento ser possível, além dos processos já praticados nas estações de tratamento de águas (ETA), foram adicionados mais dois processos de separação, que são eles:
Matéria é um agregado de partículas que possui propriedades que permite ser identificada e classificada. A seguir é dado um quadro com amostras de matérias e algumas propriedades.
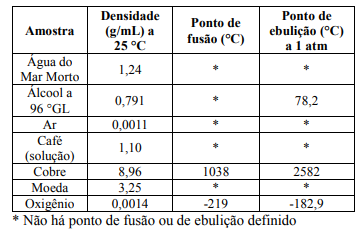
Sobre as substâncias do quadro foram feitas as seguintes proposições:
I. Cobre e moeda são substâncias simples.
II. Água do Mar Morto é uma mistura.
III. A massa de 50 mL de água do Mar Morto é de 62 g.
IV. O ar é basicamente uma mistura homogênea entre o oxigênio e nitrogênio.
V. Densidade, ponto de fusão e de ebulição são propriedades físicas da matéria.
Assinale a alternativa que contém a análise correta.

No que se refere à cromatografia líquida, julgue as afirmativas abaixo:
I. O aumento da polaridade da fase móvel causa uma redução nos tempos de retenção na cromatografia em fase normal e um aumento nos tempos de retenção na cromatografia em fase reversa.
II. Na cromatografia de fase reversa, o analito mais
polar elui depois do analito menos polar.
III. O tempo morto (tempo de retenção da fase móvel)
é o tempo necessário para que um soluto retido
passe através de uma coluna cromatográfica.
IV. A equação de van Deemter descreve a eficiência
cromatográfica, levando em consideração os
efeitos de múltiplos caminhos, da difusão
longitudinal e de transferência de massa.
Assinale a alternativa que apresenta a resposta correta:

A respeito da técnica de eletroforese capilar, analise as seguintes afirmativas: I. O uso de um capilar possibilita a dissipação do calor gerado pela passagem da corrente elétrica. II. A mobilidade eletroforética é diretamente proporcional ao coeficiente de atrito e inversamente proporcional à carga do íon. III. Na separação de espécies com caráter ácidobase, a mobilidade eletroforética dependerá do pH do eletrólito empregado na análise. IV. As amostras podem ser introduzidas por injeção hidrodinâmica ou eletrocinética.
Assinale a alternativa que apresenta a resposta correta:
I. O atomizador em chama é o mais adequado para inserção de amostras sólidas. II. Os espectros de absorção atômica são constituídos por um número ilimitado de linhas espectrais largas. III. A função do monocromador é dispersar a radiação nos comprimentos de onda que a compõe e selecionar uma faixa estreita de comprimentos de onda. IV. Em análises usando essa técnica, podem surgir interferências, como por exemplo, a interferência espectral, onde mais de um elemento pode absorver no mesmo comprimento de onda. Esse tipo de interferência pode ser eliminado selecionando comprimentos de onda diferentes.
Assinale a alternativa que apresenta a resposta correta:
No que se refere a essa técnica, analise os itens subsequentes:
I. O uso do plasma acoplado indutivamente em comparação à atomização em chama é mais vantajoso por se tratar de uma fonte de temperatura mais elevada, e, portanto o processo de atomização é mais completo, ocasionando aumento do sinal analítico. II. Um atomizador de chama proporciona maior sensibilidade que o forno de grafite, pois o tempo de residência do analito no caminho óptico é maior. III. O material do cátodo de uma lâmpada de cátodo oco independe da amostra analisada. IV. A sensibilidade da espectroscopia de absorção atômica é dependente da temperatura de atomização.
Assinale a alternativa que apresenta a resposta correta:
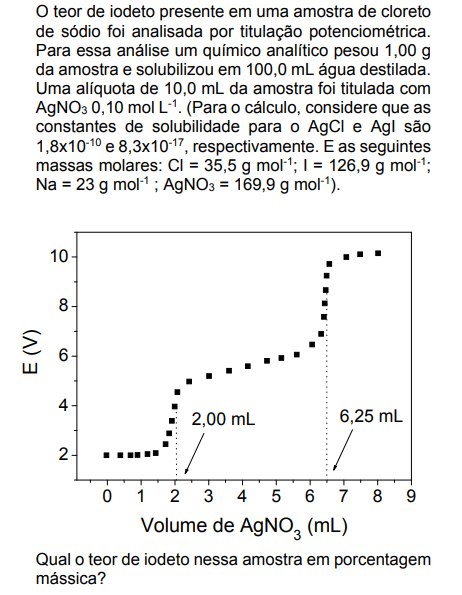




Assinale a alternativa que apresenta a resposta correta:


