Questões de Concurso Sobre química
Foram encontradas 14.919 questões
Um dos ligantes mais amplamente utilizados nas titulações de complexação é o EDTA, cuja fórmula estrutural é mostrada abaixo:
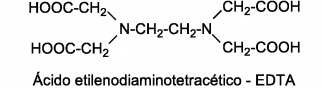
Sobre esse importante reagente, é incorreto afirmar:
Uma titulação entre uma base fraca e um ácido forte apresenta a curva de pH abaixo, onde S é o ponto estequiométrico (também chamado de ponto de equivalência).
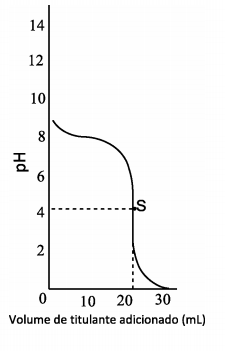
Sabendo que log 2 = 0,3 e considerando as opções apresentadas, o indicador mais eficiente para esta titulação é:
Para determinar a concentração de íons iodeto em 200 mL de uma solução, foi adicionado bromo, a fim de converter iodeto em iodato, de acordo com a reação:

Posteriormente, o íon iodato foi precipitado como iodato de bário, através da adição de íons bário:
Sabendo que se obteve, ao final do processo, 0,974 g de iodato de bário, calcule a concentração de iodeto na solução em
g/L. Massas molares (g/mol): O = 16; I = 127; Ba = 137.
O diamante de Hommel ou diagrama de risco é uma simbologia explicativa do nível de periculosidade de uma substância química. De modo esquemático, o diamante de Hommel é composto por quatro losangos com diferentes cores que simbolizam inflamabilidade, risco à saúde, reatividade e riscos específicos, de acordo com a representação abaixo:
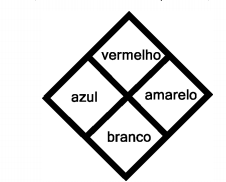
O diamante de Hommel mais adequado para estar presente numa garrafa de álcool etílico é:
Considere os átomos neutros X e Y, cujas distribuições eletrônicas são mostradas abaixo:
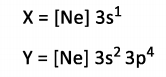
O composto formado por esses dois elementos é:
Considere os ácidos abaixo

Um estudante prepara soluções aquosas desses ácidos com a mesma concentração molar. Sobre esses ácidos e as
espécies presentes nas soluções, é correto afirmar que:
Considere a reação ácido-base de Lewis entre gás clorídrico e amônia:
Considerando 100% de rendimento, calcule o volume mínimo da mistura equimolar dos reagentes, a 27ºC e 1 atm, de
modo que seja possível a obtenção de 10,7g do produto. Massas molares (g/mol): H = 1; N = 14; Cl = 35,5.
Um técnico organiza um experimento que consiste em uma reação cujo solvente é THF (tetrahidrofurano). Ele separa a seguinte vidraria:
A intenção de utilizar este objeto indica que: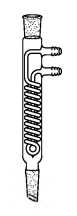
Quando, no estado gasoso, um átomo neutro de cloro absorve energia e perde um elétron, ocorre a formação de íon Cl+(g) de acordo com a equação abaixo:

A energia absorvida é definida como:
Observe abaixo a representação do equilíbrio e da curva de solubilidade (em pmol/L) de um sal hipotético XY:
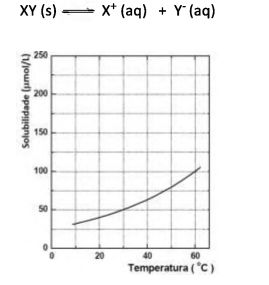
Qual é a constante do equilíbrio de solubilidade (Kps) do sal XY em 60 ºC?