Questões de Concurso Sobre química
Foram encontradas 14.919 questões
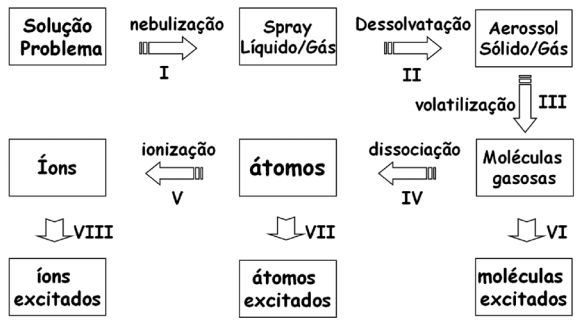
Considere o esquema e as seguintes afirmações:
I – A etapa IV é a responsável por produzir os átomos gasosos no estado fundamental. II – Na absorção atômica, utiliza-se um modulador, após a lâmpada, para eliminar os problemas que podem ser causados pela etapa VII. III – Somente a etapa V diminui a população de átomos gasosos no estado fundamental. IV – A etapa VII é indesejável para a absorção atômica, por diminuir a população de átomos gasosos no estado fundamental, porém é uma etapa essencial da espectrometria de emissão atômica.
Em relação a essas afirmativas, estão CORRETA
Considere as seguintes afirmações com respeito à espectrometria atômica.
I – Na absorção atômica, em chama, o analito deverá ser levado ao estado atômico gasoso. Após a atomização, o analito é levado ao estado excitado, tanto por absorção de energia térmica da chama quanto da radiação de frequência característica proveniente da lâmpada de cátodo oco.
II – Na absorção atômica, em chama, o analito deverá ser levado ao estado atômico gasoso. Após a atomização, o analito é levado ao estado excitado somente por absorção de energia térmica da chama, não sendo excitado pela radiação de frequência característica proveniente da lâmpada de cátodo oco.
III – Agente liberador é a espécie introduzida para combinar-se com o componente da amostra que iria apresentar interferência devido à formação de compostos de baixa volatilidade (refratários) com o analito.
IV – Agente liberador é a espécie introduzida para combinar-se com o analito, a fim de liberá-lo da interferência que sofreria devido à formação de compostos de baixa volatilidade (refratários).
Em relação a essas afirmativas, estão CORRETA
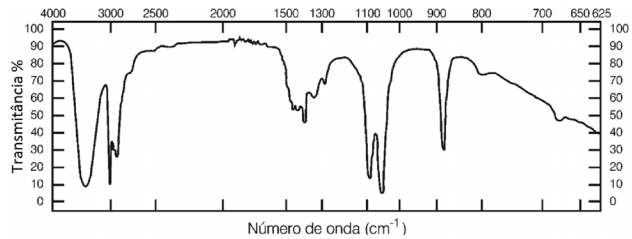
De acordo com a análise do espectro, é CORRETO afirmar que o composto é
Analito Temperatura de ebulição Constante dielétrica (oC) (ε)
n-propanona 56,05 21,01 benzeno 80,09 2,28 n-propanol 97,20 20,80 isobutanol 107,89 17,93 n-butanol 117,73 17,84 n-pentanol 137,98 15,13
I – A ordem de eluição será de acordo com as temperaturas de ebulição, ou seja, n-propanona, benzeno, n-propanol, isobutanol, n-butanol e n-pentanol, que é diferente daquela que seria obtida com uma coluna apolar. II – Se, ao invés da temperatura constante fosse utilizada uma programação linear de temperatura, a ordem de eluição seria alterada. III – A constante dielétrica fornece uma medida aproximada da polaridade da molécula. IV – Se, ao invés da temperatura constante fosse utilizada uma programação linear de temperatura, o tempo de retenção seria certamente diferente dos obtidos no modo isotérmico.
De acordo com os dados fornecidos, estão INCORRETAS as informações
Considere as seguintes semirreações:
Fe3+ + e- ⇌ Fe2+ E0 = 0,770 V
MnO4- + 5e- + 8H+ ⇌ Mn2+ + 4H2O E0 = 1,51 V
Acerca dessas semirreações, considere as afirmações a seguir:
I – A reação acontecerá de forma espontânea entre Fe3+ e MnO4- na proporção estequiométrica de 5 para 1.
II – O potencial padrão para a reação global será 2,28 V.
III – Em uma titulação entre as duas espécies, o potencial do ponto de equivalência será apenas dependente dos potenciais padrão das semirreações e do pH do meio.
IV – O íon permanganato é um agente redutor mais fraco que o íon hidrogênio.
Em relação a essas afirmativas, estão CORRETA
De acordo com esses dados, é CORRETO afirmar que a concentração do ácido muriático é, aproximadamente
Considere a reação abaixo em que as etapas intermediárias não foram mostradas.
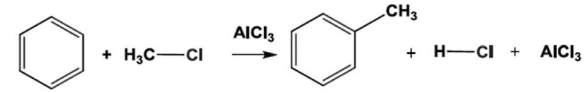
I – Nesta reação, o clorometano e o benzeno atuam como bases de Lewis.
II – Neste processo, um par de elétrons π forma uma ligação química com o eletrófilo, promovendo a formação de uma carga positiva no interior do anel benzênico.
III – Todas as etapas desta reação envolvem reações ácido-base.
IV – O cloreto de alumínio tem basicamente duas funções: preparar o eletrófilo e recuperar a aromaticidade do anel.
Em relação a essas afirmativas, estão CORRETA
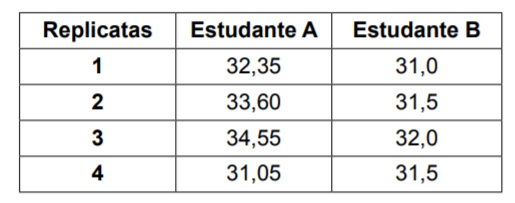
Considerando os valores mostrados na tabela é CORRETO afirmar que

Em relação à figura, leia as seguintes afirmativas.
1. I é OM π ligante. 2. II é OM σ ligante. 3. III é OM π ligante. 4. IV é OM π antiligante.
Em relação a essas afirmativas, está CORRETA
Uma solução aquosa contendo entre 25-28% em peso de amônia é comercializada como hidróxido de amônio concentrado. A molécula de amônia possui ligações ________________ e faz com moléculas de água interações do tipo ________________.
As expressões que completam CORRETAMENTE o trecho acima é
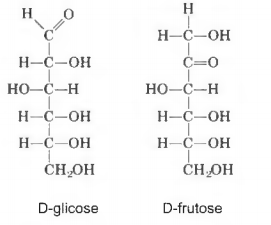
A partir das fórmulas estruturais dessas oses é possível concluir que são isômeros de função, pois a glicose é uma: