Questões de Concurso Sobre química
Foram encontradas 13.542 questões
I. Cristal de cloreto de sódio II. Água pura III. Acetona IV. n-butano V. Cloreto de sódio dissolvido em água
Agora assinale a alternativa que corresponde correta e respectivamente, à ordem crescente de força de interação das substâncias elencadas de I a V, anteriormente:
I. Calcule o trabalho quando o gás passa de A para C, através de um processo de um estágio. II. Idem em 2 estágios, passando pelo ponto B. III. Idem em infinitos estágios. IV. Calcule o trabalho quando o gás passa de C para A, através de um processo de um estágio. V. Idem em infinitos estágios.
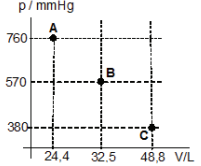 Dados:
1 pascal (1 Pa) = 1 N/m²
1 atmosfera (atm) = 1,013×105
N/m2
= 101,3 kPa
1 atm = 760 mmHg
1 torr = 1 mmHg = 133,3 Pa
1 atm.l = 101,3 J
Dados:
1 pascal (1 Pa) = 1 N/m²
1 atmosfera (atm) = 1,013×105
N/m2
= 101,3 kPa
1 atm = 760 mmHg
1 torr = 1 mmHg = 133,3 Pa
1 atm.l = 101,3 J A resposta correta para o conjunto de questões de I a V, respectivamente, é:
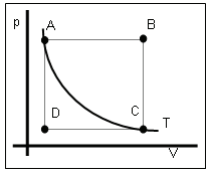 Identifique as transformações representadas por
A→B, B→C, C→D, D→A e A→C e assinale a alternativa
correta:
Identifique as transformações representadas por
A→B, B→C, C→D, D→A e A→C e assinale a alternativa
correta:Dado: 1 cal = ~4,187 J
Após analisar as afirmativas de I a V, assinale a alternativa correta:
 Assinale a alternativa que corresponde aos números de
oxidação na ordem em que aparecem no quadro:
Assinale a alternativa que corresponde aos números de
oxidação na ordem em que aparecem no quadro:Assinale a alternativa que corresponde aos balanceamentos corretos das equações de I a V, considerando somente os mínimos números inteiros:
I. No ciclo do carbono o gás carbônico na forma de gás é absorvido pelos vegetais durante a fotossíntese para formar a massa vegetal. II. Já os seres humanos e todos os demais seres vivos, ao respirarem, tanto aeróbica como anaerobicamente, liberam gás carbônico e energia, que pode ser aproveitada de diversas formas, inclusive por outros organismos. III. As reações de dissolução do gás carbônico em água são reações de equilíbrio, em fase líquida aquosa. Essas reações em equilíbrio podem participar de mecanismos de transporte de gás carbônico em meios aquosos tão diferentes como os que existem nos oceanos e do transporte de CO2 entre células e pulmões feito pelo sangue. IV. Os mesmos equilíbrios interagindo com íons metálicos podem resultar na formação de esqueletos e carapaças de organismos como conchas, casca de ovos ou na formação e dissolução de rochas e sedimentos. V. O ser humano interfere globalmente no ciclo do carbono adicionando quantidades significativas de gás carbônico na atmosfera, quando utiliza qualquer combustível contendo carbono proveniente de fonte não renovável.
Assinale a alternativa correta:
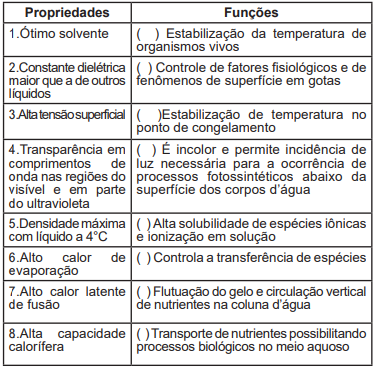
Assinale a alternativa que corresponde à ordem correta das correlações das propriedades com as funções, de cima para baixo segundo o que foi preenchido no quadro anterior:
I. Segundo a teoria de Brønsted-Lowry, o íon bicarbonato na Reação 1 é um ácido. II. Segundo a teoria de Lewis, a amônia na Reação 2 é uma base, pois ela doa elétrons. III. Segundo a teoria de Lewis, o íon bicarbonato na Reação 1 é anfótero. IV. Segundo Brønsted-Lowry, o íon carbonato na Reação 1 é uma base, chamada de base conjugada do íon bicarbonato. V. Todas as bases de Brønsted-Lowry mostradas nas equações são também consideradas bases de Lewis.
Assinale a alternativa correta:
I. As reações não vão até o fim. Elas continuam até que a composição da mistura reacional corresponda ao mínimo de entalpia. Essa composição é descrita por uma constante de equilíbrio característica da reação que depende da temperatura, dentre outros fatores. II. Para controlar o rendimento de uma reação, precisamos entender a base termodinâmica do equilíbrio e como a posição atual de equilíbrio é afetada por condições como a temperatura e a pressão, por exemplo. III. O equilíbrio químico é o estágio da reação química em que não existe mais tendência a mudar a composição da mistura da reação, isto é, as concentrações ou pressões parciais dos reagentes e produtos. Como os equilíbrios físicos, todos os equilíbrios químicos são dinâmicos, com a reação direta e inversa ocorrendo com a mesma velocidade. IV. A termodinâmica descreve quantitativamente o equilíbrio, o que nos possibilita controlar a direção e o rendimento das reações. V. A composição de uma mistura de reação no equilíbrio é descrita pela constante de equilíbrio, que é dependente do produto das atividades dos produtos (elevadas a potências iguais aos coeficientes estequiométricos da equação química balanceada da reação) dividido pelo produto das atividades dos reagentes (elevadas a potências iguais a seus coeficientes estequiométricos).
Assinale a alternativa correta:
Assinale a alternativa correta:
Assinale a alternativa correta:
Assinale a alternativa correta:
I. São favorecidas por solventes polares próticos. II. Podem resultar em misturas de isômeros ópticos. III. Podem apresentar como produtos secundário alcenos. IV. Podem ser mono ou bimoleculares. V. Podem apresentar rearranjos.
Assinale a alternativa correta:
Assinale a alternativa correta: