Questões de Concurso Sobre química
Foram encontradas 13.542 questões
A química ácido / base de muitos sistemas aquáticos naturais, incluindo rios e lagos, é dominada pela interação do íon carbonato, CO3 2-, uma base moderadamente forte, com ácido carbônico (H2 CO3 ), que é um ácido fraco. O ácido carbônico resulta da dissolução na água do gás carbônico e da decomposição da matéria orgânica na água. A fonte predominante de íon carbonato são as rochas calcárias, que são constituídas em grande medida por carbonato de cálcio (CaCO3 ). Embora esse sal seja quase insolúvel, uma pequena quantidade dele dissolve-se quando em contato com a água:
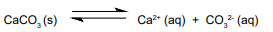
Considere que, em certa condição de temperatura do meio, a constante do produto de solubilidade (Kps) para o CaCO3 seja igual a 4 x 10–10. Nessas condições, qual é a massa de íon cálcio, em miligramas, dissolvida em 100 litros de solução?
Dado: massa atômica do cálcio = 40 u
Analise a afirmativa a seguir.
A radiação _________ é formada por partículas altamente energéticas, principalmente prótons, elétrons, nêutrons, núcleos leves e radiação gama, provenientes do espaço sideral. Um dos resultados do bombardeio constante da atmosfera superior por esse tipo de radiação é a produção dos denominados radionuclídeos _________, como o carbono-14.
Tahuata, 2014.(Adaptação)
Assinale a alternativa que completa as lacunas correta e respectivamente.
O carbono-14 apresenta tempo de meia-vida de aproximadamente 5.700 anos e é utilizado para datação radiológica de estruturas que já apresentaram vida. Durante a vida dessas estruturas, a razão carbono-14/carbono-12 é constante, diminuindo após a morte desses seres.
Se a quantidade de desintegrações por minuto (dpm) caiu de 1 840, quando ainda era um ser vivo, passando a 230 dpm, há quantos anos esse ser perdeu a vida?
Assinale a alternativa que apresenta o tipo de radiação
que completa a seguinte equação de desintegração
radioativa hipotética: 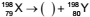 + energia
+ energia
A taxa de exposição 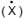 é associada à atividade
gama (A) de uma fonte radioativa, por meio do
conhecimento de sua constante de taxa de exposição
( Γ ) e da distância de interesse (d), pela expressão
é associada à atividade
gama (A) de uma fonte radioativa, por meio do
conhecimento de sua constante de taxa de exposição
( Γ ) e da distância de interesse (d), pela expressão
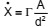 .
.
Assinale a alternativa que apresenta a taxa de exposição
de uma fonte de cobalto-57 com atividade de 100 Ci,
a uma distância de 3 metros, sabendo que sua constante
é dada por 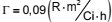 .
.
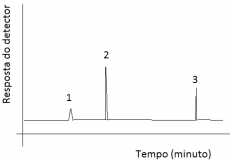
Com base em seus conhecimentos sobre a técnica, é possível afirmar que os compostos 1, 2 e 3 identificados pelo analista são, respectivamente:
NH3 (g) + HCl (g) → NH4 Cl (s) ∆H0 = –176 kJ N2 (g) + 3H2 (g) → 2NH3 (g) ∆H0 = –92,2 kJ N2 (g) + 4H2 (g) + Cl2 (g) → 2NH4 Cl (s) ∆H0 = –628,9 kJ
Com base nas equações, é correto afirmar que a entalpia de reação de síntese do gás cloreto de hidrogênio é, em quilojoules, aproximadamente igual a:
X (s) / X2+ (1,05 mol/L) // Y2+ (1,10 mol/L) / Y (s)
Sobre a notação descrita, foram feitas as seguintes afirmações. I. As duas barras (//) indicam a ponte salina. II. X representa o eletrodo do anodo e Y, o eletrodo do catodo para reações espontâneas. III. O potencial da pilha se encontra em condição diferente do padrão.
Estão corretas as afirmações:
I. Um exemplo de erro sistemático é quando se prepara uma solução com um balão volumétrico incorretamente calibrado,
PORQUE
II. esse tipo de erro surge por um problema consistente na técnica de um analista, em um instrumento ou em um procedimento.
A respeito dessas asserções, assinale a alternativa CORRETA.
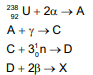
Nessas condições, é correto afirmar que o elemento X é a espécie:
