Questões de Concurso Sobre química
Foram encontradas 13.542 questões
O modelo para o átomo proposto por Thomson está representado abaixo.
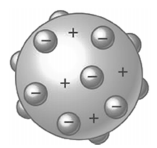
(http://www.explicatorium.com/images/modelo-Thomson.jpg. Acesso em 03/01/2016)
Com esse modelo, Thomson interpretou
Na titulação de dois sucos de laranja com hidróxido de sódio, NaOH, 0,10 mol.L−1 foram obtidos os resultados abaixo.

Considerando apenas o ácido cítrico, um ácido triprótico, conclui-se que a laranja pera é
Está representado abaixo um diagrama de entalpia para a reação Li(s) + ½ F2(g) → LiF(s).
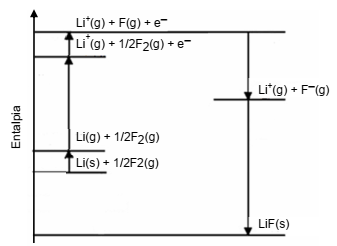
Essa reação é
Atenção: Considere as semi-reações de redução abaixo para responder à questão.
NO-3 + 4H+ + 3e- → NO + 2H2O; E0 = +0,96 V
Cu2+ + 2e− → Cu; E0 = +0,34 V
Atenção: Considere as semi-reações de redução abaixo para responder à questão.
NO-3 + 4H+ + 3e- → NO + 2H2O; E0 = +0,96 V
Cu2+ + 2e− → Cu; E0 = +0,34 V
Considere as seguintes geometrias moleculares.
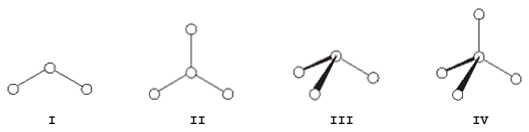
As substâncias metano, CH4, água, H2O, fosgênio, COCℓ2, e amônia, NH3, possuem, respectivamente, as geometrias moleculares
Considere a estrutura abaixo típica de um sabão.
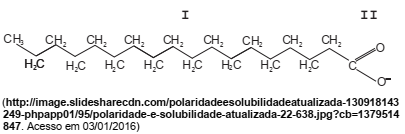
A interação da água com o sabão ocorre na parte
Atenção: Considere a equação de decomposição da nitroglicerina abaixo para responder à questão.
4C3H5N3O9 (ℓ) → 6N2 (g) + 12CO2 (g) + 10H2O (g) + O2 (g) + 6 161 kJ
Nas CATP, o volume ocupado pelo N2(g), em litros, quando reage 1 mol de nitroglicerina é igual a
Dado:
Volume molar de qualquer gás, nas CATP = 25,0 L
Atenção: Considere a equação de decomposição da nitroglicerina abaixo para responder à questão.
4C3H5N3O9 (ℓ) → 6N2 (g) + 12CO2 (g) + 10H2O (g) + O2 (g) + 6 161 kJ
Pesquisadores brasileiros criaram recentemente dois tipos de ossos sintéticos, que poderão ser usados em enxertos nas áreas de medicina e odontologia. Esses novos biomateriais são formados por polímeros e principalmente por nanopartículas minerais de hidroxiapatita, uma cerâmica bioativa que induz o crescimento do tecido ósseo na área do implante.
(Adaptado de: Revista Pesquisa FAPESP, n. 227)
A fórmula da hidroxiapatita sintética é Ca10(PO4)6(OH)2. A porcentagem em massa de oxigênio nesse composto é de
Deseja-se efetuar um banho de prata em um anel utilizando-se para tal, uma solução de nitrato de prata. O tempo necessário em segundos para depositar 1,08 g de prata utilizando-se uma corrente contínua de 1 ampère é, em segundos (s),
Dados:
Reação no cátodo: Ag+ (aq) + e− → Ag(s)
Constante de Faraday = 96 500 Coulomb/mol de elétron
Massa atômica da prata (Ag) = 108 g/mol
A bateria de chumbo é muito utilizada na indústria automotiva e no funcionamento de no-breaks usados na alimentação elétrica de computadores.
As duas semirreações de redução balanceadas desse sistema são representadas abaixo e são fornecidos os respectivos potenciais padrão (em V):
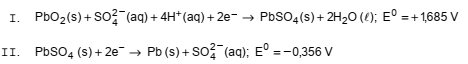
Na descarga dessa bateria, a diferença de potencial do sistema é de, aproximadamente,
O pH de uma solução 0,001 mol/L de NaOH a 25 °C em relação a uma solução 0,0001 mol/L da mesma substância à mesma temperatura será
Dados:
Kw = 1,0 × 10−14
Considere o sistema tampão entre ácido acético e acetato de sódio. A relação necessária entre concentração de base conjugada e seu ácido, para que o pH da solução tampão seja igual a 7 será
Dados:
pKa (ácido acético/acetato de sódio) = 4,74
Atenção: Considere as informações abaixo para responder a questão.
A síntese de Haber-Bosch é o método industrial para a produção de amônia utilizada na fabricação de fertilizantes e de muitos outros compostos.
A equação global de reação é dada por:
N2(g) + 3H2(g) ⇋ 2NH3(g) ΔH = −92,22 kcal . mol−1
A tabela abaixo mostra os dados experimentais da reação de síntese da amônia realizada a temperatura e pressão constantes.

Atenção: Considere as informações abaixo para responder a questão.
A síntese de Haber-Bosch é o método industrial para a produção de amônia utilizada na fabricação de fertilizantes e de muitos outros compostos.
A equação global de reação é dada por:
N2(g) + 3H2(g) ⇋ 2NH3(g) ΔH = −92,22 kcal . mol−1
A tabela abaixo mostra os dados experimentais da reação de síntese da amônia realizada a temperatura e pressão constantes.
