Questões de Concurso Sobre química
Foram encontradas 13.580 questões
Uma reação em fase gasosa se propaga em duas etapas, como indicado pelo diagrama energético a seguir:
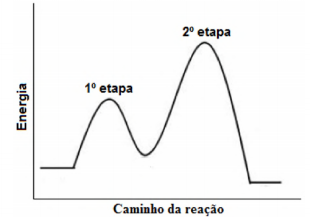
Em relação ao tema, assinale a alternativa
correta.
Considere a reação química genérica representada por x → Z , cujo gráfico da concentração de X em função do tempo é mostrada na seguinte figura.
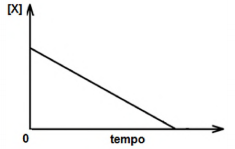
Em relação ao tema, analise as asserções a seguir:
A velocidade de consumo da substância X permanece constante durante todo o processo da reação.
PORQUE
A reação dada tem ordem global zero.
Referente às asserções, é correto
afirmar que
Três experimentos foram conduzidos, nas CNTP, objetivando investigar a cinética da reação genérica.
X + Y → Z
A tabela a seguir apresenta os resultados coletados desse experimento:

A velocidade de formação de Z, em
unidades do SI, quando as concentrações
de X e Y forem iguais a 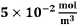 e
e 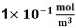 , respetivamente, é igual a
, respetivamente, é igual a
Três experimentos foram conduzidos, nas CNTP, objetivando investigar a cinética da reação genérica.
X + Y → Z
A tabela a seguir apresenta os resultados coletados desse experimento:

A constante de velocidade da reação,
em unidades do SI, é igual a
Três experimentos foram conduzidos, nas CNTP, objetivando investigar a cinética da reação genérica.
X + Y → Z
A tabela a seguir apresenta os resultados coletados desse experimento:

A ordem global da reação é igual a
Considere os seguintes potenciais normais de redução, de três metais genéricos X, Y e Z, respectivamente:
X2+ + 2 e- → X° E° = - 0 ,7 5 V
Y2+ + 2 e- → Y° E° = + 0 ,3 5 V
Z+ + e- → Z° E° = + 0 ,8 0 V
Assinale a alternativa que apresenta o melhor agente oxidante.
Considere a pilha ilustrada na figura a seguir, em que as soluções de ZnSO4 e CuSO4 foram empregadas com concentração inicial de 1 mol/L.
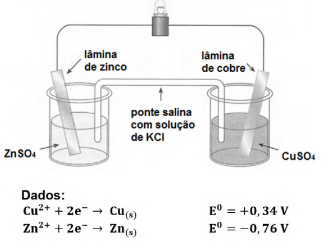
Acerca da situação apresentada, assinale a alternativa INCORRETA.
O estoque de uma companhia possuía resinas termofixas e termoplásticas. Um estagiário precisava apanhar os recipientes das duas únicas resinas termofixas que estavam nesse estoque.
Os recipientes escolhidos foram de
Uma solução de NaCℓ foi feita dissolvendo, totalmente, 0,100 g do sal em água antes de transferir essa mistura para um balão volumétrico de 100,00 mL onde a solução teve seu volume ajustado. A incerteza da massa de NaCℓ é 0,001 g (calculada considerando duas etapas: a tara e a pesagem propriamente dita do sal), e a incerteza do balão é 0,10 mL.
Assim, essa solução teria uma incerteza de concentração, em gL-1 , de
O potencial padrão de redução do Fe3+ (ver equação I) é +0,77 V em relação ao eletrodo padrão de hidrogênio (EPH). O eletrodo de referência de calomelano, ou Hg/Hg2Cℓ2 (KCℓsat), tem potencial de redução (ver equação II) igual a +0,24 V em relação ao EPH.
I - Fe3+ (aq) + e → Fe2+ (aq) E° = +0,77 V
II - Hg2Cℓ2(s) + e → 2 Hg(ℓ) + 2 Cℓ- (aq) E° = +0,24 V
Assim sendo, o potencial de redução padrão do Fe3+, em V, em relação ao eletrodo de referência de calomelano é
Uma solução de álcool desinfetante foi preparada, a 20°C, com água e etanol, sendo que a quantidade desse último na mistura foi de 71,2% massa/massa. O valor aproximado da pressão de vapor da mistura, em mmHg, é
Dados
Pressão de vapor do etanol puro: 44 mmHg a 20°C
Pressão de vapor da água pura: 18 mmHg a 20°C
M (água) = 18,00 g mol-1
M (etanol) = 46 g mol-1
Uma solução ideal foi feita misturando 360,00 mL de água e 1 mol de um soluto não volátil, armazenando a mesma a 20°C.
O valor aproximado da pressão de vapor, em mmHg, da mistura é
Dados
Pressão de vapor da água pura: 18 mmHg a 20°C
Massa específica da água pura: 1,00 g mL-1
M (H2O) = 18,00 g mol-1
Um eletrodo é formado por um fio de prata recoberto com uma camada de AgBr(s). A reação de redução característica do eletrodo é representada na equação abaixo.
AgBr(s) + e ⇋ Ag(s) + Br - (aq)
A aplicação desse eletrodo em potenciometria é de
A determinação de glicose foi feita em quatro réplicas, isto é, n = 4, em uma amostra coletada em jejum. Os seguintes resultados foram obtidos: 91,0 mg dL-1 ; 95,0 mg dL-1 ; 96,0 mg dL-1 e 98,0 mg dL-1 , com desvio padrão 2,9 mg dL-1 . A distribuição dos dados tende à normalidade (com t = 3,2 para 3 graus de liberdade e com 95% de limite de confiança).
Considerando o valor médio e o intervalo de confiança do resultado, o valor mais próximo, em mg dL-1 , da maior concentração admitida para glicose na amostra é
Um procedimento gravimétrico foi realizado de acordo com as instruções da literatura. Um precipitado foi obtido após a mistura da solução de amostra com a solução do reagente precipitante (esta última adicionada em quantidade para garantir excesso estequiométrico). Por conta das características do precipitado, uma fração ficou suspensa na solução (suspensão coloidal) e foi perdida na filtragem para recolher o sólido. Após secagem, a massa final do precipitado foi medida em balança calibrada. O procedimento foi repetido três vezes para se obter um valor médio de massa de analito e seu desvio padrão.
Com relação aos erros associados ao resultado, tem-se
A reação representada abaixo é a titulação potenciométrica de Cr2+ com solução padrão de Ce4+, usando um eletrodo indicador de Pt.
Cr2+ + Ce4+ → Cr3+ + Ce3+
Antes do ponto de equivalência, quando a concentração de Cr2+ é 100 vezes maior que a de Cr3+, o potencial medido, em V (numa temperatura T em que RT/F = 0,06 V), é
Dados
Potenciais em relação ao eletrodo padrão de hidrogênio.
Cr3+ + e → Cr2+ Eo = - 0,41 V
Ce4+ + e → Ce3+ Eo
= +1,44 V
Na espectrometria de absorção atômica com atomização eletrotérmica, o analista controla o aquecimento do atomizador.
Em um programa de aquecimento em etapas e com faixas de temperatura típicas, uma das etapas é a pirólise, cujo objetivo é