Questões de Concurso Sobre química
Foram encontradas 13.580 questões
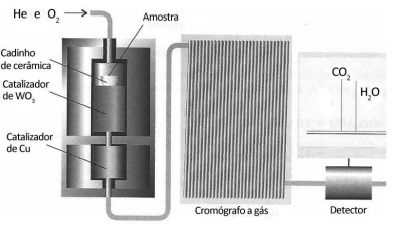
Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água. A fórmula empírica desse composto é: Dados: Massas Molares: H = 1g.mol–1 C = 12g.mol–1 O=16g.mol–1
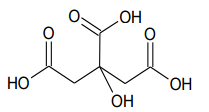
Assinale a opção que expressa a acidez da amostra. Dados. Massa molar. Ácido Cítrico: 192 g.mol –1 .
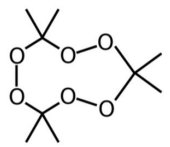 Esta molécula é obtida pela reação da acetona com água
oxigenada e, portanto, não contém nitrogênio, tornando mais
fácil a sua passagem por dispositivos de segurança que detectam
compostos nitrogenados.
Na reação de síntese do TATP citada no enunciado, os carbonos
Esta molécula é obtida pela reação da acetona com água
oxigenada e, portanto, não contém nitrogênio, tornando mais
fácil a sua passagem por dispositivos de segurança que detectam
compostos nitrogenados.
Na reação de síntese do TATP citada no enunciado, os carbonos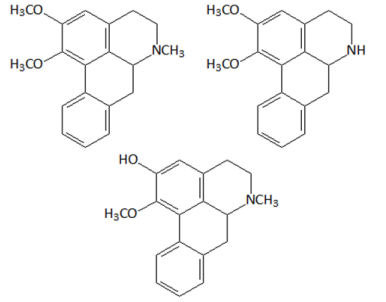
Assinale a opção que indica as funções orgânicas caracterizadas pelos grupos funcionais presentes nessas moléculas.
Ca5 (PO4)3F (s) + H2SO4 (aq)
 Ca(H2PO4
)2
(aq) + CaSO4
(aq) + HF (g)
Ca(H2PO4
)2
(aq) + CaSO4
(aq) + HF (g)
A soma dos menores coeficientes inteiros que balanceiam esta equação é
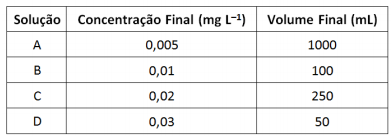
Sobre as soluções preparadas são feitas as afirmativas a seguir. I. Para preparar as soluções A e C foram utilizados os mesmos volumes da solução padrão. II. Para preparar a solução B foi utilizado o menor volume da solução padrão. III. Para preparar a solução D foi utilizado o maior volume da solução padrão. Está correto o que se afirma em
Considerando os compostos a seguir:
MnO2, KMnO4 e MnCI2
O número de oxidação (Nox) do átomo de manganês em cada composto, respectivamente, é igual a: