Questões de Concurso Sobre química
Foram encontradas 13.580 questões
Analise as reações abaixo.
I. SO2 + H2O2 -› H2SO4
II. SO2 + H2O -› H2SO3
III. SO2 + NH4OH -› NH4HSO3
Das reações, ocorre o fenômeno de oxirredução em
O volume, em litros (L), de uma solução de H2SO4 1,0 mol L-1 que reage com 0,5 mol de NaOH é:
Na reação de zinco metálico (Zn(s)) com ácido clorídrico (HCl(aq)), há formação de cloreto de
zinco (ZnCl2(aq)) e gás hidrogênio (H2(g)), conforme a seguinte equação:
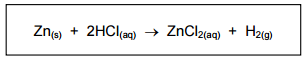
Nessa reação, o HCl é consumido e a tabela a seguir mostra a sua concentração em função do tempo.
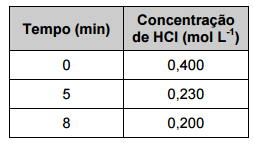
A alternativa que apresenta o valor correto da velocidade média da reação (mol L-1 min-1
) no intervalo de 5 a
8 minutos é
A reação de 1 mol de grafita, C(s), com 1 mol de oxigênio gasoso produz 1 mol de dióxido de carbono gasoso. O diagrama abaixo mostra a variação de entalpia para essa reação.
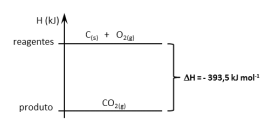
Analise as afirmativas abaixo sobre essa reação.
I. A energia liberada pode ser chamada de entalpia de formação de CO2(g).
II. A energia liberada pode ser chamada de entalpia de combustão de grafita.
III. É uma reação endotérmica.
IV. Para queimar 1 mol de C(s), é necessário fornecer 393,5 kJ para o sistema.
Está(ão) CORRETA(S):
Durante um procedimento de preparação de soluções no laboratório de alimentos, o analista precisa pesar a massa necessária para preparar as soluções abaixo descritas: (Dados: H=1; Na=23; C=12; O=16).
I - 500 mL de uma solução de concentração 0,02 N de carbonato de sódio (Na2CO3), que será utilizada para a padronização de soluções;
II - 1 litro de solução de ácido acético (C2H4O2) 0,025 M, que será usada para a titulação
de soluções.
As massas que devem ser pesadas para a preparação das soluções I e II, respectivamente ,
são:
Atenção: A questão refere-se ao conteúdo de Conhecimentos em Gás Natural.
O Gás Natural Liquefeito (GNL) é basicamente gás natural que, após purificado, é condensado ao estado líquido por meio da
redução da sua temperatura a −163 °C. A vantagem de se liquefazer o gás natural é
Atenção: A questão refere-se ao conteúdo de Conhecimentos em Gás Natural.
O gás natural de uma determinada tubulação tem o Limite Inferior de Explosividade de aproximadamente 5% em volume e o
Limite Superior de Explosividade de aproximadamente 15% em volume. Isso significa que, se essa tubulação se romper e
provocar uma mistura entre gás natural e ar, em que o gás natural esteja a uma concentração de 20% em volume
O ácido benzoico foi descoberto no século XVI e recebeu esse nome por ter sido extraído do benjoeiro.
Em 1875, Salkowski verificou que esse ácido atua como fungicida
e, desde então, o ácido benzoico vem sendo usado como
germicida na preservação de alimentos e como adjuvante
farmacológico anti-fúngico, normalmente em concentrações que
variam entre 0,05 a 0,15%. Trata-se de um composto de fórmula
molecular C7H6O2 (massa molar = 122 g.mo -1) pouco solúvel em
água.
-1) pouco solúvel em
água.
Em uma solução aquosa, comporta-se como um ácido fraco, com pKa = 4.
Uma solução aquosa de ácido benzoico em concentração 0,12%
(m/v) apresenta pH aproximadamente igual a
A reação 2HI(g) 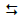 H2(g) + I2(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
H2(g) + I2(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
Assinale a opção que apresenta o valor correto da constante de
equilíbrio Kc.
A cinética da reação de brometo de benzila com benzilamina foi estudada por Ravi e colaboradores. Os autores verificaram que a reação é de primeira ordem com respeito a cada reagente.
A reação é esquematizada a seguir:
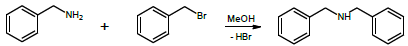
Em um experimento conduzido a 298 K, com excesso de benzilamina, o perfil de decaimento do brometo de benzila foi registrado, sendo apresentado na figura a seguir.
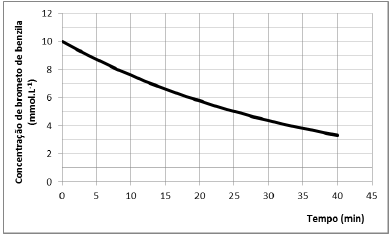
Nessas condições, o tempo (em minutos) em que a concentração
de brometo de benzila terá sido reduzida à 1/8 da concentração
inicial é de
Em um ensaio de corrosão, placas bimetálicas (Fe/Ag, Fe/Cu, Fe/Mg, Fe/Ni e Fe/Zn) foram dispostas em diferentes bécheres contendo água do mar, conforme o esquema a seguir:
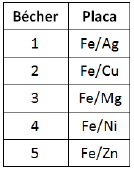
Considere a tabela a seguir.
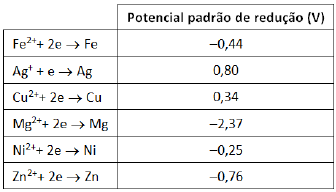
Após o mesmo tempo de observação, o bécher em que se verifica
a menor taxa de corrosão da placa de ferro é o
 , é possível esperar
, é possível esperar