Questões de Concurso Sobre química
Foram encontradas 13.580 questões
Visando adequar-se aos conceitos de síntese limpa, a indústria química tem procurado substituir antigas rotas sintéticas por outras que possibilitem minimizar a geração de resíduos e os riscos ambientais a eles associados. Um exemplo disso é o processo industrial desenvolvido para a síntese do analgésico ibuprofeno, da Hoechst-Celanese, a partir do composto X representado no esquema da figura a seguir. Esse processo é com posto de três etapas, apresenta reduzido emprego de solventes e resulta em uma utilização atômica de cerca de 77%. Tal processo representou considerável avanço em relação à rota clássica, da companhia Boots, também mostrado na figura, que possui 6 etapas e uma pobre utilização atômica, além de requerer o uso de elevadas quantidades de solvente e provocar geração de sais residuais.

Considerando as rotas sintéticas apresentadas no texto, suas reações e com postos envolvidos, julgue o item seguinte.
A etapa 1 da rota sintética de Boots corresponde a uma reação
de adição eletrofílica ao anel de benzeno.
Visando adequar-se aos conceitos de síntese limpa, a indústria química tem procurado substituir antigas rotas sintéticas por outras que possibilitem minimizar a geração de resíduos e os riscos ambientais a eles associados. Um exemplo disso é o processo industrial desenvolvido para a síntese do analgésico ibuprofeno, da Hoechst-Celanese, a partir do composto X representado no esquema da figura a seguir. Esse processo é com posto de três etapas, apresenta reduzido emprego de solventes e resulta em uma utilização atômica de cerca de 77%. Tal processo representou considerável avanço em relação à rota clássica, da companhia Boots, também mostrado na figura, que possui 6 etapas e uma pobre utilização atômica, além de requerer o uso de elevadas quantidades de solvente e provocar geração de sais residuais.

Considerando as rotas sintéticas apresentadas no texto, suas reações e com postos envolvidos, julgue o item seguinte.
No esquema apresentado, o com posto B 1 é o produto principal
da acilação do com posto X, que pode ser obtido a partir da
alquilação do benzeno. Se as etapas forem invertidas, ou seja,
se for realizada primeiramente a acilação do benzeno e,
posteriormente, a alquilação da cetona obtida, ainda assim,
será obtido, preferencialmente, o com posto B 1.
Visando adequar-se aos conceitos de síntese limpa, a indústria química tem procurado substituir antigas rotas sintéticas por outras que possibilitem minimizar a geração de resíduos e os riscos ambientais a eles associados. Um exemplo disso é o processo industrial desenvolvido para a síntese do analgésico ibuprofeno, da Hoechst-Celanese, a partir do composto X representado no esquema da figura a seguir. Esse processo é com posto de três etapas, apresenta reduzido emprego de solventes e resulta em uma utilização atômica de cerca de 77%. Tal processo representou considerável avanço em relação à rota clássica, da companhia Boots, também mostrado na figura, que possui 6 etapas e uma pobre utilização atômica, além de requerer o uso de elevadas quantidades de solvente e provocar geração de sais residuais.

Considerando as rotas sintéticas apresentadas no texto, suas reações e com postos envolvidos, julgue o item seguinte.
O composto X, material de partida para os processos em
apreço, pode ser obtido a partir da reação do benzeno com o
cloreto de ter-butila, catalisada por A1C13.
Visando adequar-se aos conceitos de síntese limpa, a indústria química tem procurado substituir antigas rotas sintéticas por outras que possibilitem minimizar a geração de resíduos e os riscos ambientais a eles associados. Um exemplo disso é o processo industrial desenvolvido para a síntese do analgésico ibuprofeno, da Hoechst-Celanese, a partir do composto X representado no esquema da figura a seguir. Esse processo é com posto de três etapas, apresenta reduzido emprego de solventes e resulta em uma utilização atômica de cerca de 77%. Tal processo representou considerável avanço em relação à rota clássica, da companhia Boots, também mostrado na figura, que possui 6 etapas e uma pobre utilização atômica, além de requerer o uso de elevadas quantidades de solvente e provocar geração de sais residuais.

Considerando as rotas sintéticas apresentadas no texto, suas reações e com postos envolvidos, julgue o item seguinte.
A massa molar do com posto X é igual a 134,0 g/mol.
Os dados da tabela acima se referem a testes realizados, a 298 K, utilizando-se o método das velocidades iniciais, para determinação da lei de velocidade para a reação do BO3-(aq) com o Br-(aq) em meio ácido. A equação não balanceada para essa reação é a seguinte.
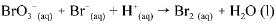
A respeito da reação acima e dos com postos nela envolvidos, e considerando as informações fornecidas, julgue o item que se segue.
A menor soma de coeficientes inteiros que permite balancear
corretam ente a equação da reação em questão é 12.
Os dados da tabela acima se referem a testes realizados, a 298 K, utilizando-se o método das velocidades iniciais, para determinação da lei de velocidade para a reação do BO3-(aq) com o Br-(aq) em meio ácido. A equação não balanceada para essa reação é a seguinte.
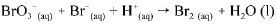
A respeito da reação acima e dos com postos nela envolvidos, e considerando as informações fornecidas, julgue o item que se segue.
A reação em questão pode ser considerada uma reação de oxi-redução.
Considere as seguintes entalpias padrões, 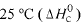
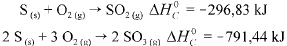
Com base nessas informações, julgue o item que se segue.
A molécula de SO2 é apoiar, enquanto a de SO3 é polar
Considere as seguintes entalpias padrões, 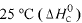
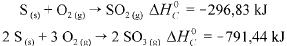
Com base nessas informações, julgue o item que se segue.
A entalpia padrão da reação 2 SO2(g) + O2(g) → 2 SO3(g), a 25
°C ,é igual a -197,78 kJ.
Considere as seguintes entalpias padrões, 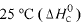
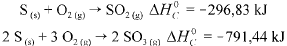
Com base nessas informações, julgue o item que se segue.
O módulo da entalpia padrão de formação do SO3(g), a 25 °C, é m aior que 700 kJ/mol.
O calor e a entalpia de combustão do ácido benzoico foram determinados por meio de um calorímetro que opera a volume constante e cuja capacidade calorífica é de 10.000 J. A queima de 1,00 g do ácido ocasionou um aumento de 2,64 °C na temperatura do sistema. A equação que representa a combustão do ácido benzoico é apresentada a seguir.
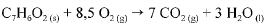
Considerando que todos os gases envolvidos na reação de combustão do ácido benzoico tenham com portamento ideal e desprezando a contribuição de líquidos e sólidos para a pressão dentro do sistema, julgue o próximo item.
O módulo da entalpia de combustão do ácido benzoico é maior
que o módulo do calor de combustão nas condições do
experimento calorimétrico realizado.
O calor e a entalpia de combustão do ácido benzoico foram determinados por meio de um calorímetro que opera a volume constante e cuja capacidade calorífica é de 10.000 J. A queima de 1,00 g do ácido ocasionou um aumento de 2,64 °C na temperatura do sistema. A equação que representa a combustão do ácido benzoico é apresentada a seguir.
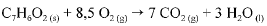
Considerando que todos os gases envolvidos na reação de combustão do ácido benzoico tenham com portamento ideal e desprezando a contribuição de líquidos e sólidos para a pressão dentro do sistema, julgue o próximo item.
Os dados fornecidos permitem concluir que o módulo do calor
de combustão a volume constante do ácido benzoico é maior
que 400 kJ/mol.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
A polaridade da ligação H— X, em que X corresponde a um
halogênio, é maior no HC1 que no HBr.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
Se o volume da solução de HC1 gasto quando atingido o ponto
de equivalência na titulação for igual a 21,0 mL, a concentração
da solução de NH4OH preparada é menor que o 0,10 mol/L
pretendido.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
A molécula de NH3 é apoiar e apresenta geometria trigonal
plana.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
Em uma solução de NH4OH, a 25 °C, o produto das atividades
dos íons hidrônio e dos íons hidróxido é maior que 1,0 x 10-14
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 -5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
A 25 °C, a porcentagem de dissociação do NH4OH em uma
solução 0,10 mol/L é superior a 1 %.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
O indicador ácido-base mais apropriado para a detecção do
ponto final da titulação deve apresentar a faixa de viragem em
pH ácido.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
O volume de solução estoque em pregada para a preparação da
solução desejada foi superior a 8,0 mL.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
De acordo com os dados fornecidos no rótulo do frasco, a
concentração da solução estoque de NH4OH é superior a 7,0
mol/L.
O bombardeamento do urânio-235 com nêutrons induz a um a série de reações de fissão nuclear altamente energéticas. Em uma dessas reações, após a captura de um nêutron (1n), o urânio se desintegra para formar um átomo de césio-137, um isótopo X, e dois outros nêutrons capazes de gerar uma reação em cadeia:
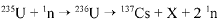
O césio-137 assim formado é um isótopo radioativo que emite radiações gama e beta e pode ser em pregado em radioterapia com o intuito de destruir células cancerosas.
A partir do texto acima e considerando que o tempo de m eia-vida do césio-137 é de 30 anos, julgue o item que se segue.
Mesmo após um período de 300 anos, mais de 1% dos átomos
de césio-137 deverão estar ativos.
