Questões de Concurso Sobre química
Foram encontradas 13.785 questões
A vitamina A, também chamada de retinol, é encontrada em alimentos de origem animal e vegetal. Sua estrutura está representada a seguir:
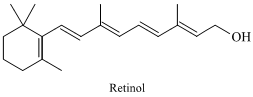
A função orgânica presente na estrutura do retinol é
Considere o seguinte diagrama de entalpia:
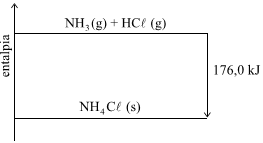
Esse diagrama representa uma reação
A transformação de carbonato de cálcio em óxido de cálcio pode ser representada pela equação a seguir:
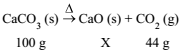
A massa, em gramas, correspondente a X é igual a
Considere as seguintes representações para átomos: 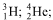
 O número de nêutrons de cada átomo é, respectivamente,
O número de nêutrons de cada átomo é, respectivamente,
Na determinação volumétrica de ácido fosfórico em um medicamento fortificante e antianêmico, foram anotados os seguintes dados:
– alíquota da amostra analisada = 20,0 mL;
– volume de NaOH, 0,100 mol.L–1 gasto na titulação da amostra = 9,0 mL;
– reação envolvida: H3 PO4 + 3NaOH → Na3 PO4 + 3H2O.
De acordo com os dados da análise, a concentração, em
mol.L–1
, de ácido fosfórico no medicamento é de
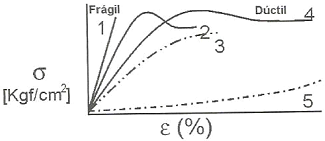
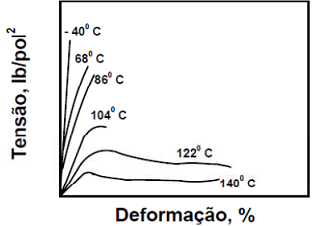
O comportamento de deformação mecânica
dos polímeros está fundamentado na
viscoelasticidade desses materiais. O ensaio de
tração possibilita a determinação de diversas
propriedades mecânicas dos materiais. Sendo
assim, analise a figura abaixo e marque a
alternativa CORRETA:
Os plásticos (polímeros) possuem centenas de aplicações, como impermeabilizantes, sacolas plásticas, bolsas de sangue, pratos descartáveis, garrafas plásticas, dentre outros produtos. Os polímeros termoplásticos são os mais utilizados e também apresentam a vantagem de poderem ser reprocessados (reciclados) após o uso. Para melhor classificar esses polímeros e facilitar sua reciclagem, a Associação Brasileira de Normas Técnicas regulamentou a norma NBR 13230-2008 – “Embalagens e acondicionamento plásticos recicláveis – Identificação e simbologia”. Observe as afirmativas:
I. Esta norma não contempla embalagens compostas por outros materiais que não sejam plástico.
II.  este símbolo, que encontramos na
norma, pertence à resina termoplástica
polietileno de alta densidade.
este símbolo, que encontramos na
norma, pertence à resina termoplástica
polietileno de alta densidade.
III. Segundo a norma, todas as embalagens constituídas por mistura de resinas, inclusive aquelas que estão classificadas de 1 a 6, devem ter indicado o número 7(outros) dentro do símbolo.
Qual(is) afirmativa(s) acima está(ão)
CORRETA(S)?
Em relação à moldagem por sopro, classifique cada uma das afirmativas abaixo como VERDADEIRA (V) ou FALSA (F) e, em seguida, assinale a alternativa correta, na sequência de cima para baixo.
( ) Existem duas formas básicas para moldagem por sopro: moldagem por sopro via extrusão e moldagem por sopro via sopragem.
( ) A diferença fundamental entre os dois modos básicos para a moldagem por sopro reside na maneira como o parison é produzido.
( ) O parison é um pistão que empurra o material a ser moldado, evitando, assim, perdas de material durante o processamento.
( ) A moldagem por sopro via extrusão é apta à produção de grandes quantidades de artefatos, mas produz moldados com rebarbas.
( ) Uma vantagem da moldagem a sopro via
extrusão é que o extrusado pode se apresentar em
praticamente qualquer comprimento.