Questões de Concurso Sobre química
Foram encontradas 14.919 questões
Dadas as afirmativas sobre a composição do gás natural,
I. O N2 é um gás inerte que, se presente em alto teor, pode provocar a redução do poder calorífico do gás natural.
II. O O2 e o H2 são compostos comuns na composição do gás natural.
III. O CO2 pode provocar danos em tubulações e equipamentos devido ao seu alto poder de corrosão.
verifica-se que está(ão) correta(s)
Dadas as afirmações,
I. O gás natural é encontrado no subsolo, por acumulações em rochas porosas.
II. O gás natural é o efeito da degradação anaeróbia da matéria orgânica que, em épocas pré-históricas, acumulava-se nas águas litorâneas dos mares.
III. Alguns elementos que contribuíram para a degradação da matéria orgânica em épocas pré-históricas foram as baixas temperaturas e pressões.
verifica-se que está(ão) correta(s)
Atenção: Considere as seguintes vidrarias de laboratório para responder à questão.

Atenção: Considere as seguintes vidrarias de laboratório para responder à questão.

Nas normas sobre um laboratório químico, foram definidas, entre outras regras, os seguintes procedimentos para descarte pela rede de esgoto:
- Proibido descarte de materiais sedimentáveis ou que possam causar obstrução das canalizações.
- Proibido descarte de solventes, gasolina, óleos leves e substâncias explosivas ou inflamáveis em geral.
- Concentrações máximas permitidas para descarte: cianeto 0,2 mg/l; chumbo, mercúrio, arsênio 1,5 mg/l.
Dados: M (g.mol-1): C = 12; Pb = 207, N = 14; Na = 23.
Sobre o tema, considere as seguintes afirmativas:
1. Fosfato de cálcio deve ser descartado em bombonas para sólidos.
2. Vidrarias com graxas podem ser enxaguadas com heptano.
3. Uma amostra de 20 mL de uma solução
3 μmol.L-1 de cianeto de sódio pode ser descartada pela rede de esgoto.
4. O resíduo de um experimento que contém 10 μmol.L-1 de nitrato de chumbo deve ser tratado para descarte.
Assinale a alternativa correta.
O laboratório que está sujeito à norma na questão anterior é um gerador contínuo de resíduos de mercúrio. O tratamento adequado desses resíduos consiste na sua acidificação com ácido nítrico seguido da adição de tioacetamida (CH3SNH2). Esse último sofre decomposição, gerando íons sulfeto em meio ácido.
Dados: M (g.mol-1 ): Hg = 200; S = 32; N = 14; H = 1; KPS: HgS = 2 x 10-53 .
Uma bombona de 20L contém um resíduo de mercúrio em concentração de 0,1 mol.L-1 . Qual é a massa (em gramas) mínima necessária de tioacetamida para tratar esse resíduo?
O conhecimento químico, o planejamento e a condução correta dos procedimentos são fundamentais para a segurança no laboratório de química. Acerca do tema, identifique como verdadeiras (V) ou falsas (F) as afirmativas a seguir:
( ) Os EPIs devem ficar disponíveis no laboratório químico em local acessível em caso de acidente.
( ) Em caso de queimadura com ácido, o técnico deve tratar o local com uma base.
( ) Luvas e máscaras devem ser escolhidas em função da finalidade a que se destinam.
( ) Chuveiros lava-olhos fazem parte dos EPCs, assim como extintores de incêndio e capelas de exaustão.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Polímeros são macromoléculas formadas a partir de reação de polimerização. Os polímeros possuem diversas aplicações que permeiam nosso dia a dia. Sobre o tema, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) Plásticos são polímeros lineares ou ramificados que são facilmente moldados.
( ) Os termorrígidos são constituídos de polímeros tridimensionais.
( ) O látex é um polímero natural que contém, na maioria, o trans-polisopreno.
( ) Os plásticos podem ser reciclados, diferentemente dos termorrígidos.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
A reação de halogenação de arenos é uma das principais reações orgânicas. O clorobenzeno (esquema abaixo), um dos principais produtos dessa reação, foi utilizado por décadas como solvente de herbicidas, mas hoje é evitado devido a problemas ambientais.
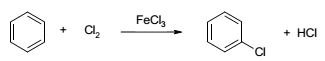
Sobre o tema, considere as afirmativas a seguir:
1. A reação corresponde a uma substituição eletrofílica.
2. O cloreto férrico, catalisador, é um ácido de Lewis.
3. No mecanismo da reação, cloreto é adicionado ao areno numa primeira etapa e hidreto é eliminado na segunda etapa.
4. A halogenação ocorre a temperatura ambiente, mas a remoção do haleto do areno requer condições bastante drásticas.
Assinale a alternativa correta.
Na ciência forense utilizam-se comumente de testes presuntivos para averiguar vestígios de sangue nas cenas de crimes. Um teste comum utiliza o reagente de Kastle-Meyer, que consiste numa solução alcalina de fenolftalina (1). No teste, a amostra coletada em material absorvente é mergulhada no reagente e em seguida adicionam-se algumas gotas de H2O2. Se a amostra adquirir tom rosado significa que o teste forneceu resultado positivo para presença de sangue. No processo, forma-se fenolftaleína (2).

A respeito do assunto, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) O processo se baseia no efeito tamponante do sangue.
( ) A cor rosa é resultado da presença do indicador na forma protonada.
( ) A fenolftalina é oxidada no processo.
( ) O peróxido é o catalisador da reação.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Compostos orgânicos são susceptíveis a desidratação por um agente desidratante, como ácido sulfúrico concentrado ou pentóxido de fósforo e altas temperaturas, sendo a desidratação uma importante rota de síntese. Sobre a desidratação, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) A desidratação de etanol produz éter etílico.
( ) A desidratação de álcoois secundários e terciários produzem alcenos.
( ) A desidratação do ácido acético leva à formação de ceteno, o qual reage com ácido e forma o anidrido acético.
( ) A desidratação do ácido fórmico com ácido sulfúrico concentrado gera monóxido de carbono.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
O ácido lático, ou ácido 2-hidroxipropanoico, é um composto que participa de vários processos bioquímicos. Na molécula de ácido lático existe um carbono quiral. Sobre o assunto, considere as seguintes afirmativas:
1. Um isômero do ácido lático é chamado de dextrógero e o outro de levógero.
2. Uma amostra que não desvia o plano da luz polarizada evidencia que a molécula não tem atividade ótica.
3. Isômeros óticos do ácido lático possuem temperatura de fusão e ebulição distintas.
4. Os isômeros óticos do ácido lático exibem diferentes espectros eletrônicos.
Assinale a alternativa correta.