Questões de Concurso Sobre química
Foram encontradas 13.580 questões
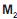 O e MO. Considere as afirmações abaixo sobre esse elemento e seus compostos.
O e MO. Considere as afirmações abaixo sobre esse elemento e seus compostos.I - O elemento M pertence ao grupo dos metais alcali- nos.
II - No composto MO, o oxigênio apresenta estado de oxidação -1.
III - O elemento M apresenta dois estados de oxidação.
IV - No composto
 O, o oxigênio apresenta estado de oxidação -2.
O, o oxigênio apresenta estado de oxidação -2.São corretas APENAS as afirmativas
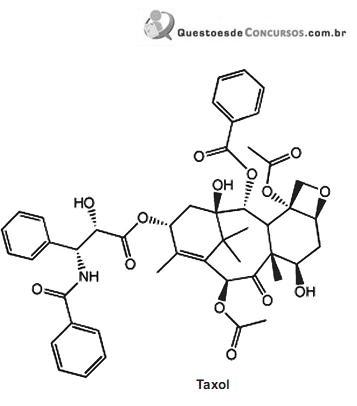
O taxol é um diterpenoide natural que possui uma enorme atividade anticancerígena.
O único grupo funcional que NÃO está presente no taxol denomina-se
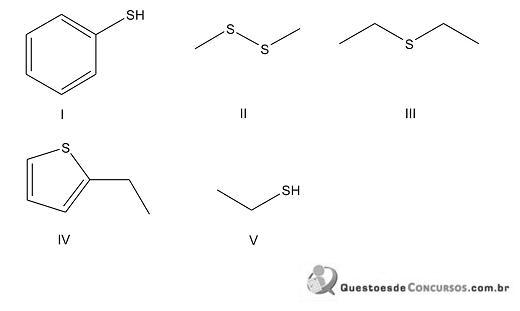
A respeito dos compostos I, II, III, IV e V acima representados, tem-se que
Um exemplo de danos materiais (e também culturais) causado pela chuva ácida ocorre na Grécia, onde diversos monumentos históricos feitos de mármore foram danificados, forçando o governo a trocar algumas esculturas por réplicas. Os principais agentes da chuva ácida são óxidos do nitrogênio e do enxofre. Considere que 3,20 g de enxofre foram queimados em excesso de gás oxigênio, originando o óxido onde o enxofre se encontra em seu maior estado de oxidação. Tal óxido foi recolhido em quantidade suficiente de água em um erlenmeyer onde foi introduzido um pedaço de mármore de 10,00 g. Se todas as etapas do processo apresentam rendimento de 100 %, e apenas 80,0 % do mármore é formado por carbonato de cálcio, ao final da última reação, a massa de gás liberada, em g, foi de
O buraco na camada de ozônio era causado por gases conhecidos como CFC’s, os cloro-flúor-carbonos, que interferiam no equilíbrio existente entre o gás oxigênio e o ozônio. Analise as afirmações abaixo sobre o ozônio e o oxigênio.
I - A hibridação do oxigênio central do ozônio é sp2 e a geometria molecular é angular.
II - O ozônio e o gás oxigênio por serem formados pelo mesmo elemento, são isômeros.
III - As ligações entre os oxigênios são mais fracas no ozônio que no gás oxigênio.
IV - O ozônio e o gás oxigênio são conhecidos pelo forte caráter redutor.
Estão corretas as afirmativas
I - Em uma série de soluções-padrão, de um determinado analito quanto mais fraca for a cor da solução, maior será a transmitância.
II - O caminho ótico é o diâmetro externo da cubeta e não o seu diâmetro interno.
III - A absorvância é diretamente proporcional ao poder radiante e ao comprimento de onda.
Está correto APENAS o que se afirma em
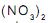 de concentração igual a 1,0 mol.L-1 e deixadas em repouso por algumas horas. Sendo dados os potenciais padrão de redução:
de concentração igual a 1,0 mol.L-1 e deixadas em repouso por algumas horas. Sendo dados os potenciais padrão de redução: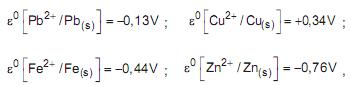
será observada oxidação APENAS na(s) placa(s) de
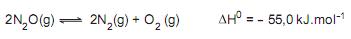
apresenta energia de ativação igual a 121 kJ.mol -1 , se ouro for empregado como catalisador e 134 kJ.mol -1 se, alternativamente, platina for empregada como catalisador. Sobre esse sistema fechado, considere as afirmativas a seguir
I – Um aumento de temperatura diminuiria o tempo para se atingir o equilíbrio e aumentaria o rendimento do processo.
II – O emprego de ouro como catalisador conduz o processo mais rapidamente ao equilíbrio, quando comparado ao emprego de platina.
III – A uma dada temperatura, o emprego dos catalisadores ao processo altera a velocidade da reação, no entanto as concentrações dos gases no equilíbrio permanecem inalteradas.
IV – Um aumento da pressão total do sistema (pela diminuição do volume) levaria a um aumento do rendimento da reação no equilíbrio.
Estão corretas APENAS as afirmativas
Uma definição muito comum e que possibilita tal medida é considerar que o raio atômico é a metade da distância entre os núcleos de átomos vizinhos de uma substância simples. Essa definição permite a determinação de raios atômicos para grande parte dos elementos, mas alguns deles não podem ter seus valores de raio determinados segundo essa metodologia, por não formarem substâncias simples com ligações entre os átomos. Um exemplo desses elementos é o
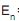 = –72,0/n2 , onde n é o número quântico principal. Considere a constante de Planck h = 4,14 × 10–15 e V.s e a velocidade de propagação da onda eletromagnética no vácuo c = 3,00 × 108 m/s. O comprimento de onda, em nm, de fótons provenientes da transição do nível n = 3 para o nível n = 2, propagando-se em um meio onde o índice de refração vale 2,00, é
= –72,0/n2 , onde n é o número quântico principal. Considere a constante de Planck h = 4,14 × 10–15 e V.s e a velocidade de propagação da onda eletromagnética no vácuo c = 3,00 × 108 m/s. O comprimento de onda, em nm, de fótons provenientes da transição do nível n = 3 para o nível n = 2, propagando-se em um meio onde o índice de refração vale 2,00, é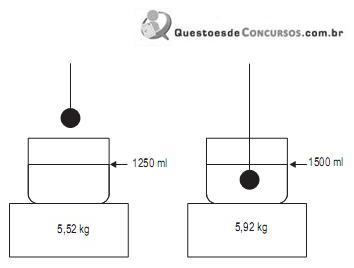
Nesse caso, a densidade do líquido, determinada corretamente pelo laboratorista, em g/cm3 , é

A uma determinada temperatura, para esse sistema, tem- se que a constante de equilíbrio, em termos das concentrações molares dos gases, Kc é igual a 5,00.10-2 . Se 40,0 g de carbonato de cálcio forem adicionados em um reator de 5,00 L, inicialmente isento de dióxido de carbono, a porcentagem de decomposição do sal, quando o equilíbrio químico for atingido, será igual a
I – Uma solução saturada de brometo de potássio na temperatura de 20 °C tem concentração de 70% (m/m).
II – É possível dissolver 300 g de iodeto de potássio em 200 g de água numa temperatura de 50 °C.
III – Ao serem comparadas soluções saturadas de KI e KBr a 90 °C, o número de mols do cátion potássio é maior na solução de iodeto.
IV – 180 g de KI foram dissolvidos em 200 g de água a 85 °C e diminuindo a temperatura para 10 °C, formam-se 20 g de precipitado.
Estão corretas as afirmativas
