Questões de Concurso
Comentadas sobre representação das transformações químicas em química
Foram encontradas 337 questões

A molécula de fenolftaleína, cuja estrutura é mostrada na figura precedente, apresenta dois hidrogênios ácidos que, conforme o pH, podem se ionizar de acordo com os equilíbrios a seguir. H2Ind, HInd- e Ind2- representam as formas protonada, monoionizada e di-ionizada da molécula, respectivamente.
H2Ind (aq) + H2O ⇄ HInd- (aq) + H3O+ (aq)
HInd- (aq) + H2O ⇄ Ind2- (aq) + H3O+ (aq)
Uma vez que as espécies com diferentes graus de
protonação apresentam cores diferentes, a coloração de uma
solução de fenolftaleína depende do pH do meio.
Tendo a figura e as informações precedentes como referência, julgue o item subsequente.
A fórmula molecular da fenolftaleína protonada é C20H16O4.
Considerando que as constantes de ionização ácida do H2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
A massa de H2S presente em 250 mL de uma solução aquosa
com concentração 0,100 mol/L do ácido é superior a 1,0 g.
De acordo com a nova definição de mol recomendada pela IUPAC, um mol contém exatamente 6,02214076 × 1023 entidades elementares. Esse número é o valor numérico fixo da constante Avogadro, NA, quando expresso em mol-1 , e é chamado de número de Avogadro. A nova definição enfatiza que a quantidade de substância está relacionada com as entidades de contagem em vez da massa de uma amostra.
Internet:<https://iupac.org>
Com relação a essas informações, julgue o item que se segue.
Considere que m1 gramas de H2(g) reajam completamente
com 6,0 gramas de C(s), de acordo com a reação I,
e que m2 gramas de O2(g) reajam completamente com
6,0 gramas de C(s), de acordo com a reação II. Conforme
a lei de Richter, são necessários 2 × m1 gramas de H2(g) para
reagir completamente com m2 gramas de O2(g), de acordo
com a reação III.
De acordo com a nova definição de mol recomendada pela IUPAC, um mol contém exatamente 6,02214076 × 1023 entidades elementares. Esse número é o valor numérico fixo da constante Avogadro, NA, quando expresso em mol-1 , e é chamado de número de Avogadro. A nova definição enfatiza que a quantidade de substância está relacionada com as entidades de contagem em vez da massa de uma amostra.
Internet:<https://iupac.org>
Com relação a essas informações, julgue o item que se segue.
De acordo com a reação I, são necessárias mais de 24 × 1023
moléculas de H2(g) para a formação de 32,0 g de metano.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
Sendo a pólvora formada somente por salitre, enxofre e carvão,
na mesma proporção molar da reação apresentada, a queima
de 10,0 g de pólvora produzirá mais de 3,0 g de sulfeto
de potássio (K2S).
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
A equação apresentada desobedece ao princípio de Lavoisier, uma vez que a massa dos produtos é menor que a massa dos reagentes devido à presença de gases de baixa densidade formados pela reação.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
A massa molar do composto formado pelo ânion do carbonato
de potássio e o cátion do nitrato de alumínio é maior que
250,0 g/mol.
Objetivando estudar a Lei Ponderal de Lavoisier, um estudante realizou o experimento esquematizado a seguir, em que o líquido do frasco A corresponde a uma solução aquosa de ácido sulfúrico (H2SO4) e o sólido contido no frasco B representa uma amostra de carbonato de sódio (Na2CO3).
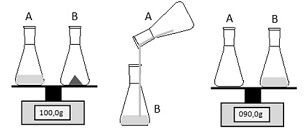
Ao final do processo o estudante notou, pela leitura no visor da
balança, que a massa resultante era diferente da massa inicial. No
contexto do experimento, essa situação foi verificada porque
O processo de extração do ferro é altamente poluente, uma vez que, além da queima de combustíveis fósseis para alimentar os altos-fornos, ocorre a transformação de carvão em monóxido de carbono, conforme ilustrado na reação a seguir envolvendo o minério hematita:
Fe2O3 + 3C → 2Fe + 3CO
Assinale a alternativa que indica a massa de CO produzida no processamento de uma tonelada de hematita. (Pesos atômicos: C = 12, O = 16, Fe = 56.)
A ureia (CO(NH2)2) é uma substância utilizada como fertilizante. Ela pode ser obtida pela reação entre o gás carbônico e amónia, conforme a equação a seguir:
CO2(g) + 2 NH3(g) → CO(NH2)2(s) + H2O(g)
Sabendo-se que 44,8 litros de amónia gasosa reagem completamente em um processo com o gás carbônico, assinale a alternativa que apresenta massa de ureia sólida obtida. (Considerar CNTP).
O clorato de potássio (KClO3), quando aquecido, se decompõe segundo a equação química abaixo.
2 KClO3(s) → 2 KCℓ(s ) + 3O2(g)
Uma mistura com massa desconhecida contém apenas KCℓO3 e KCℓ e foi aquecida produzindo 0,175 mol do gás oxigênio proveniente da reação de decomposição completa do KCℓO3. Após o aquecimento, a massa final de KCℓ foi de 25,0 g.
Dessa forma, a massa total aproximada, em gramas, da mistura que foi aquecida era de
Dados
M(KCℓ) = 75 g mol-1
M (KCℓO3) = 123 g mol-1
Num experimento químico eram necessários 60 gramas de iodeto de cobre (I), mas este reagente estava em falta. Assim a solução do problema era fabricá-lo de acordo com a reação química a seguir:
KI(aq) + CuSO4(aq) → I2(s) + K2SO4(aq) + CuI(s)
Quantos gramas de sulfato de cobre (II) serão necessários para formar a quantidade exata de iodeto
de cobre (I)?
O ferro metálico pode ser obtido industrialmente por meio da seguinte reação não balanceada:
Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
Considerando uma reação com transformação
total de produtos em reagentes, assinale a
alternativa correta sobre esse processo.
O carbonato de cálcio, CaCO3(s), decompõe-se com aquecimento para produzir CaO(s) e CO2(g). Uma amostra de CaCO3 é decomposta e o dióxido de carbono é coletado num frasco de 300 mL. Depois de completada a decomposição, o gás tem pressão de 1,5 atm à temperatura de 27°C. Qual é a quantidade aproximada de matéria, em mol de CO2, produzida na decomposição?
Dados:
R = 0,0821 L atm/K.mol
Massas molares (g/mol): C = 12; Ca = 40 e O = 16.
Considere que um técnico de laboratório busque maneiras de melhorar o processo pela qual o minério de ferro, contendo Fe2O3 , é convertido em ferro. Em seus testes, ele realizou a seguinte reação em pequena escala.
Fe2O3 (s) + 3CO(g) → 2Fe(s) + 3CO2(g)
Nessas condições, admitindo que há 150 g de Fe2O3 como reagente limitante, qual é aproximadamente o rendimento teórico de ferro?