Questões de Concurso
Comentadas sobre representação das transformações químicas em química
Foram encontradas 778 questões
C5H12 (g) + 8 O2 (g) → 5 CO2 (g) + 6 H2O (g),
em que todos os gases estão nas mesmas condições de pressão e temperatura. Com base nessas informações, assinale a opção que corresponde ao volume de oxigênio necessário para produzir 60 m3 de gás carbônico.
A massa, em gramas, de PbI 2 , sólido que se forma ao se misturarem 100,00 mL de cada uma das soluções, é
Dados M(KI) = 166 g/mol M(Pb(NO3)2) = 331 g/mol M(Pbl2) = 461 g/mol
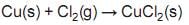
Uma mistura em equilíbrio contém 20 g de Cu, 35 g de Cl2 e 198 g de CuCl2 num recipiente de 2,5 L de capacidade. Identifique a alternativa que apresenta, respectivamente, as concentrações molares (mol/L) do Cu, Cl2 e do CuCl2.
A perda por calcinação, expressa em percentual de CO2 na amostra original é de:
(Dado C= 12, H = 1 e O=16)
(Dado: Zn = 65,5)
xC4H10 + y02 → wC02 + zH20

Dados:
Relações molares: 1 mol O2 / 4 mol Fe2+ ; 1 mol Cr2O72- / 6 mol Fe2+ e 6 mol O2 / 4 mol Cr2O72-
Dados: ln 2 = 0,693 e ln 5 = 1,609
A equação química acima descreve a queima do gás metano, uma reação de combustão muito utilizada na indústria. A partir dessas informações, julgue os itens a seguir.
A equação química acima descreve a queima do gás metano, uma reação de combustão muito utilizada na indústria. A partir dessas informações, julgue os itens a seguir.
x FeTiO3 (s) + y Cl2 (g) + z C (s) → aFeCL2 (s) + βTiO2 (s) + y CO2 (g)
Considerando as contribuições de Lavoisier, assinale a opção que apresenta um conjunto de valores dos coeficientes x, y, z, a, β e y, respectivamente, que tornam essa equação balanceada.
Fe (s) + H2 SO4 (aq) → FeSO4 (aq) + H2 (g)
Ao término da reação, o ácido foi totalmente consumido, sobrando ferro sem reagir. A solução resultante passou por um processo controlado de evaporação, obtendo-se o sal hidratado FeSO4 .7H2O. A massa do sal hidratado obtida deve ter sido, em gramas, aproximadamente igual a
