Questões de Concurso
Comentadas sobre representação das transformações químicas em química
Foram encontradas 327 questões
Dados: massa molar do NaCl = 58,5g/mol
Dados: Massas atômicas (u), em valores aproximados: K = 39; C = 12; H = 1; O = 16; Cl = 35,5.
2 NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(l)
Diante dessas informações, essa reação irá produzir Dado: R (constante dos gases ideais) = 0,08 L·atm·mol−1 ·K−1.
Após a leitura, assinale a opção que mostra O SOMATÓRIO DOS COEFICIENTES ESTEQUIOMÉTRICOS, expressos com os menores inteiros, da reação citada na etapa 1 acima, A GEOMETRIA MOLECULAR da arsina e o ESTADO DE OXIDAÇÃO (Nox) do arsênio no ácido arsênico, respectivamente:
Dados: massas molares (g.mol-1): S =32; Fe=56.
Se 44kg de sulfeto de ferro(II) contendo impurezas inertes produziram 6,8kg de gás sulfídrico, a porcentagem de pureza desse sulfeto é de
Dado: R = 0,082 atm.L.mol–1. K –1
Zn (s) + 2MnO2 (aq) + 2NH4+ (aq) → Zn2+ (aq) + Mn2O3 (s) + 2NH3 (g) + H2O (ℓ) Essa pilha não é recarregável e deixa de funcionar quando todo o dióxido de manganês é consumido. Sobre o funcionamento da pilha de Leclanché, analise as afirmativas a seguir.
I. No anodo ocorre a oxidação do zinco, liberando dois elétrons. II. No cátodo ocorre a redução do manganês, liberando dois elétrons. III. No polo negativo, o íon amônio sofre oxidação.
Está correto o que se afirma em
Considerando o sal comum formado apenas por cloreto de sódio, a quantidade máxima de sal que pode ser utilizada por dia, por pessoa, segundo a OMS é de, aproximadamente,
Dados: massas molares (g.mol-1): Na =23; Cℓ =35,5.

O gás CO2 de um extintor de incêndio é mais denso do que o ar. À medida que o CO2 sai do extintor, resfria-se significativamente. O vapor d´água no ar é condensado pelo CO2 frio e forma uma nuvem branca.
O fator que faz com que o gás que sai do extintor seja mais denso que o ar é a
O número de moléculas desse gás lançadas por ano na atmosfera é de, aproximadamente,
Gregos teriam decorado seus vasos funerários com gesso, revela estudo
“Um estudo realizado por pesquisadores da Universidade de Palermo, localizada na Itália, descobriu que os antigos gregos teriam usado gesso para fazer algumas das pinturas presentes em seus vasos funerários (...). Eles puderam identificar sulfato de cálcio (origem do gesso) nas figuras brancas presentes em vasos de fundo preto ou vermelho, o que lhes permitiu entender melhor o processo de desenvolvimento desses objetos artísticos”. (Adaptado)”
Fonte: https://aventurasnahistoria.uol.com.br/noticias/historia-hoje/gregosteriam-decorado-seus-vasos-funerarios-com-gesso-revela-estudo.phtml. Acesso em 10/01/2023
A fórmula molecular da substância química identificada nas figuras dos vasos funerários é:
Dados: N (Z=7); O (Z=8)
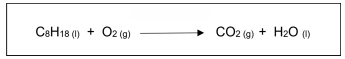
Para queimar completamente 2,00 mols de octano, serão necessários: