Questões de Concurso
Comentadas sobre representação das transformações químicas em química
Foram encontradas 1.177 questões
O número de moléculas desse gás lançadas por ano na atmosfera é de, aproximadamente,
I.A água pesada (D2O) é uma forma de água onde os átomos de hidrogênio são substituídos por deuterium, um isótopo do hidrogênio.
II.A densidade do gelo de D2O é quase idêntica à densidade da água líquida de D2O.
III.O ponto de fusão do gelo de água pesada (D2O) é maior que o do gelo de água comum (H2O).
É correto o que se afirma em:
Gregos teriam decorado seus vasos funerários com gesso, revela estudo
“Um estudo realizado por pesquisadores da Universidade de Palermo, localizada na Itália, descobriu que os antigos gregos teriam usado gesso para fazer algumas das pinturas presentes em seus vasos funerários (...). Eles puderam identificar sulfato de cálcio (origem do gesso) nas figuras brancas presentes em vasos de fundo preto ou vermelho, o que lhes permitiu entender melhor o processo de desenvolvimento desses objetos artísticos”. (Adaptado)”
Fonte: https://aventurasnahistoria.uol.com.br/noticias/historia-hoje/gregosteriam-decorado-seus-vasos-funerarios-com-gesso-revela-estudo.phtml. Acesso em 10/01/2023
A fórmula molecular da substância química identificada nas figuras dos vasos funerários é:
1ª. Etapa: S + O2 → SO2 2ª. Etapa: SO2 + O2 → SO3 3ª. Etapa: SO3 + H2O → H2SO4
Ao fazermos o balanceamento para as 2ª e 3ª etapas, utilizando somente os menores coeficientes inteiros, assinale a alternativa correta.
Dados: N (Z=7); O (Z=8)
Ca5(PO4)3 F + H3PO4 + H2O HF + Ca(H2PO4)2 . H2O (I)
Em um processo industrial, partiu-se de 1 tonelada de fluorapatita fazendo-a reagir com uma quantidade suficiente de ácido fosfórico obtendo-se, ao final, 2 toneladas do produto di-hidrogenofosfato de cálcio monohidratado. Pode-se, por esses dados, prever que a pureza do mineral utilizado, em percentual, era aproximadamente igual a:
(Dados, em g/mol: Ca= 40, P=31, O=16, H=1, F=19)
(Dados em g/mol: Na= 23, O = 16, H = 1)
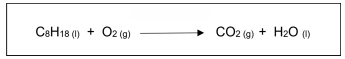
Para queimar completamente 2,00 mols de octano, serão necessários:
(MnO4) - (aq) + H2C2O4(aq) + H+ (aq) → Mn2+(aq) + H2O(l) + CO2(g)
A soma dos menores coeficientes inteiros que balanceiam a equação é:
Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
Após o balanceamento, a somatória dos menores coeficientes estequiométricos (números inteiros) para a reação química apresentada será de:
A respeito de estequiometria, processo de fabricação, corrosão e soldagem, julgue o item a seguir.
Considere-se que a reação para a produção de biodiesel ocorra a partir de 1 mol de triglicerídeo (TRIG) e 3 mols de metanol (MET), na presença de um catalisador (NaOH), para formar monoésteres de ácidos graxos (BIO = biodiesel) e 1 mol de glicerina (GLI), conforme a equação que se segue.
1 TRIG + 3 MET → BIO + 1 GLI
Com base nessa hipótese e considerando-se a massa molar
do metanol igual a 32 g/mol e a massa molar da glicerina
igual a 60 g/mol, é correto afirmar que, se forem utilizados
960 kg de metanol na presença de um excesso de
triglicerídeos, para um rendimento de 80% a massa
resultante de glicerina será de 480 kg.