Questões de Concurso
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 334 questões
NαN3(s) ➔ Na(s) + N2(g)
Qual o volume total (L) de gás N2 é liberado em uma colisão, se o airbag contém 100 g de azida de sódio?
Dados: Massa molar (g mol-1): Na=23 N=14 K=39 0=16
Volume molar (CNTP) = 22,8 L
C2H5OH+ 3O2 → 2CO2+3H2O
Se 4,6 g de etanol são completamente queimados, qual é o volume de gás carbônico produzido nas CNTP? Dados: Massa molar do etanol: 46 g/mol e Volume molar dos gases nas CNTP: 22,4 L/mol.
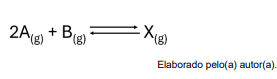
Segundo o principío de Le Chatelier, a alteração no sistema que deve ser feita para que equilíbrio favoreça a formação de reagentes é
Use: R = 0,082 atm . L . mol-1 K-1
A + A + B
 C + D
C + D A molecularidade dessa reação é:
Com relação a essa situação hipotética, julgue o item seguinte, considerando que todos os gases se comportem idealmente, que não haja processo de liquefação ou vaporização e que 0 K = −273 °C.
Se, às 18 h, a temperatura ambiente, em equilíbrio térmico
com o gás, alcançar 30 °C, então, nessa nova situação, a
pressão de gases no tanque será superior a 22 MPa.
No que se refere à modificação de superfícies, julgue o seguinte item.
A engenharia de superfície envolve a alteração das
propriedades da fase a granel para reduzir a degradação do
material ao longo do tempo, o que é conseguido ao se tornar
a superfície maleável ao ambiente em que será usada.
De acordo com os conceitos que abarcam a estrutura da matéria, as transformações químicas e a matéria em seus diferentes estados, julgue (C ou E) o item a seguir.
Todos os gases, em qualquer condição de temperatura e pressão, obedecem à equação dos gases perfeitos: pV = nRT, em que p é a pressão, V é o volume, n é quantidade de matéria, R é a constante dos gases e T é a temperatura.
De acordo com os conceitos que abarcam a estrutura da matéria, as transformações químicas e a matéria em seus diferentes estados, julgue (C ou E) o item a seguir.
Em um recipiente que encerra uma mistura gasosa, a pressão total é a soma das pressões parciais.
Em relação aos conceitos de mol, massa molar e concentração de soluções, julgue o item.
Conceitualmente, é correto afirmar que uma entidade elementar equivale a 6,022×1023 mols.
Nessa situação final, a temperatura do balão, em K, é
Dado T(K) = T(°C) + 273
Por volta de 1920, dois cientistas, o bioquímico russo Aleksandr I. Oparin (1894 - 1980) e o biólogo inglês John B. S. Haldane (1892 - 1964) apresentaram seus resultados baseados no estudo da teoria da evolução química do biólogo inglês Thomas H. Huxley (1825 - 1895). Segundo a teoria, a Terra primitiva continha compostos químicos inorgânicos, que combinados a fenômenos físicos como descargas elétricas produziriam compostos orgânicos, que são a base da vida na Terra. Porém, esta hipótese só foi testada em laboratório em 1953 pelos cientistas Stanley L. Miller (1930 - 2007) e Harold C. Urey (1893 - 1981).
PILLING, S. Química prebiótica e formas de vida primitiva. Astroquímica, Universidade do Vale da Paraíba. Disponível em: <https://www1.univap.br/spilling/AQ/Aula%2015%20- %20Quimica%20prebiotica.pdf>. Acesso em: 13 ago. 2023.
A hipótese de Oparin e Haldane foi testada por Miller e Urey, que inseriram em um sistema fechado vapor de água e os gases
ClO− (aq) + 3I− (aq) + 2H+ (aq) → I 3 − (aq) + Cl− (aq) + H2 O (L)
Considere, hipoteticamente, que essa reação rápida forneceu os seguintes dados experimentais:
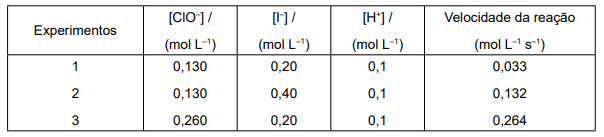
Com base nos dados experimentais, qual é a expressão matemática que descreve a lei de velocidade?