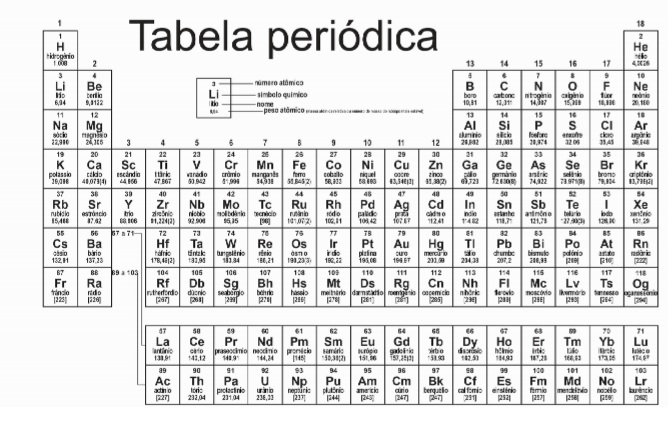
Questões de Concurso
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 334 questões
Considere: Densidade da água a 27°C = 0,99654 g/cm3 R = 0,08206 L atm/mol K T(K) = t(ºC)+273
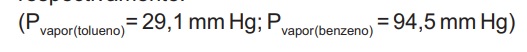
Verifique as assertivas e assinale a INCORRETA
Um método experimental para determinar a massa molecular de um gás está baseado na medida de sua densidade. Sabendo que a densidade do gás fosfina é 1,1 g L-1 a 100ºC e 747 mmHg e que esse gás se comporta idealmente, a massa molecular da fosfina é igual a:
Dados: 1 atm = 760 mmHg; T (K) = t (ºC) + 273,2 (K); R = 0,0821 L atm K-1 mol-1.
(Dados: PM: H=1,0 g/mol; R=0,08206 atmL/molK; a=0,244 L2atm/mol2; b=0,02661 L/mol.)
I. Pela Lei de Boyel, um gráfico de volume versus pressão é uma parábola. II. O princípio de Avogadro pressupõe a existência de átomos e moléculas e principalmente, que no estado gasoso os átomos ou moléculas de um gás têm um tamanho muito pequeno quando comparados com o volume ocupado pelo conjunto de átomos ou moléculas do gás. Isso implica que o espaço vazio entre as moléculas gasosas deveria ser muito maior que as próprias moléculas. III. A pressão exercida por uma mistura de gases ideais é igual à soma das pressões parciais de cada gás da mistura. A pressão parcial de um gás ideal em uma mistura é definida como a pressão que ele exerceria se ocupasse sozinho o volume ocupado pela mistura na mesma temperatura da mistura.
Os dados da literatura científica mostram que K = 54, em 700 K, para a reação:

Considere uma mistura de hidrogênio, iodo e gás iodídrico em 700 K, cujas pressões parciais dos gases sejam 10 bar, 8
bar e 1 bar, respectivamente. Sobre essa mistura reacional e os valores do quociente de reação (Q) e da constante de
equilíbrio (K), é correto afirmar que:
Um método clássico de se obter ferro é a partir da redução da hematita (Fe3Ü2), de acordo com a reação abaixo

Realizando o processo descrito acima e considerando uma siderúrgica com produção diária de 2,8 toneladas de ferro,
calcule o volume de dióxido de carbono liberado por dia, a 1 atm e 27ºC. Massas molares (g/mol): C = 12; O = 16; Fe = 56
Dado: a 250°C o Kp = 1,78 atm.
O volume e a forma dos gases são variáveis; os gases se expandem e adquirem a forma do recipiente em que são colocados. Com relação ao estado gasoso e a suas propriedades, assinale a alternativa correta.