Questões de Concurso
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 330 questões
Acerca das propriedades dos gases, julgue o item subsequente.
À pressão e temperatura constantes, o volume ocupado por uma determinada quantidade de gás é inversamente proporcional ao número de moléculas gasosas presentes.
Acerca das propriedades dos gases, julgue o item subsequente.
À pressão constante, o volume ocupado por uma quantidade de gás é inversamente proporcional à sua temperatura absoluta Kelvin.
Acerca das propriedades dos gases, julgue o item subsequente.
À temperatura constante, o volume ocupado por uma determinada quantidade de gás é diretamente proporcional à sua pressão.
Acerca das propriedades dos gases, julgue o item subsequente.
O gás é definido como a forma fluida da matéria que se expande espontaneamente, enche o recipiente que ocupa de maneira uniforme e pode ser facilmente comprimida a um volume muito menor. O volume, a pressão e a temperatura são variáveis usadas para descrever o comportamento dos gases.
5 g de gás hidrogênio (H2) foram misturados com 32 g de gás oxigênio (O2), em um recipiente de 10 L a 27 °C. Considerando o comportamento da mistura como o modelo de gás ideal, podemos informar que a pressão total do sistema em atmosfera vale:
Adotar nessa questão: R = 0,082 atm.L. mol-1 . K-1; T(K) = 273 + T(°C); Massas atômicas: H = 1 e O = 16.
Adotar nessa questão: R = 0,082 atm.L. mol-1 . K-1; T(K) = 273 + T(°C)
Dois recipientes contendo, respectivamente, gás oxigênio e gás nitrogênio a uma temperatura de 25 °C estão interligados conforme a figura abaixo:
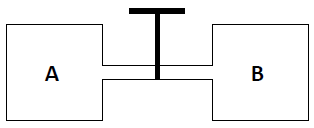
Sabe-se que o volume de oxigênio contido no
recipiente A é de 1,5 L e sua pressão é 0,5 atm e o
volume ocupado pelo nitrogênio no recipiente B é 0,5
L e sua pressão é 1,0 atm. Quando a válvula é
aberta, a pressão total da mistura e a fração molar
do gás oxigênio são em valores aproximados,
respectivamente

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 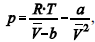 julgue o item que segue.
julgue o item que segue.
A temperatura T2 é inferior àquela verificada imediatamente
antes da compressão.
56,0 g de nitrogênio gasoso foram inseridos em um pneu, a 25 °C. Considerando que a capacidade do pneu é de 10,0 litros, a pressão atingida pelo gás nesse pneu, em atmosferas, a essa temperatura, foi de, aproximadamente,
Dado:
Constante universal dos gases = 0,082 atm.L.mol−1 . K−1
Atenção: Considere a equação de decomposição da nitroglicerina abaixo para responder à questão.
4C3H5N3O9 (ℓ) → 6N2 (g) + 12CO2 (g) + 10H2O (g) + O2 (g) + 6 161 kJ
Nas CATP, o volume ocupado pelo N2(g), em litros, quando reage 1 mol de nitroglicerina é igual a
Dado:
Volume molar de qualquer gás, nas CATP = 25,0 L
Na mistura, a pressão parcial, em atm, do CO2 é
Sabendo-se que a massa de Ne na mistura é 4 vezes maior que a massa de H2 , a pressão parcial do H2 , em atm, teria um valor mais próximo de
Dado M (H2 ) = 2 g mol-1 M (Ne) = 20 g mol-1 (RT/V) = 1 atm mol-1
Um mol de gás hélio (He) e um mol de gás carbônico (CO2) são encerrados em um vaso rígido de 10,0 L. Nesse sistema gasoso, considerando condições ideais, tem-se que
Dado
M (He) = 2 g mol-1
M (CO2
) = 44 g mol-1
Um recipiente de 20 L contém uma mistura de nitrogênio e um gás não identificado, a 305 K. A massa de nitrogênio no recipiente é 168 g, enquanto a massa do outro gás é igual a 88 g.
Se a pressão total no recipiente é 10 atm, e o comportamento dos gases é ideal, o gás não identificado na mistura pode ser o
Dado
R = 0,082 atm L mol-1
K-1
Considere o texto a seguir para responder à questão.
A reação de ionização do ácido clorídrico, HCl(g) → H+(aq) + Cl-(aq) , processa-se a 25°C e 1 atm e são conhecidos os seguintes valores termodinâmicos ΔH = -75 kj/mol e ΔS = -131, 5 J/(mol. K).
Acerca da entropia da reação, analise as asserções a seguir:
O valor negativo de ΔS indica que um mol de H+(aq) mais um mol de Cl-(q) são menos desordenados que um mol de HCl gasoso separado do solvente água.
PORQUE
Os íons aquosos são mais desordenados que compostos no estado gasoso.
Referente às asserções, é correto afirmar que
O hexafluoreto de urânio é uma substância de importância tecnológica, sendo utilizado como matéria prima para obtenção e enriquecimento do urânio metálico. A figura a seguir apresenta o diagrama de fases dessa substância:

IAEA - International Atomic Energy Agency. Disponível em: https://www.iaea.org (Adaptado).
Uma amostra de 704 g de hexafluoreto de urânio, inicialmente a 30°C e 1 atm, foi submetida aos seguintes procedimentos, realizados em sequência, em um laboratório:
1. aquecimento à pressão constante até 100°C;
2. compressão isotérmica (100°C) até 7 atm;
3. resfriamento à pressão constante (7 atm) até 20°C.